自己免疫疾患や免疫不全を引き起こすTRAF3遺伝子、IBDとの関連は不明だった
国立成育医療研究センターは4月10日、炎症性腸疾患(IBD)の発症に関与する新たな遺伝子変異を初めて同定したと発表した。この研究は、同センター消化器科の新井勝大診療部長・竹内一朗医師、免疫アレルギー感染研究部/アレルギーセンターの森田英明室長、周産期病態研究部および群馬大学大学院医学系研究科分子細胞生物学の秦健一郎教授・谷口公介准教授らの研究グループによるもの。研究成果は、「Intestinal Research」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
IBDは消化管の慢性的な炎症を特徴とする疾患で、主にクローン病と潰瘍性大腸炎に分類される。IBD患者の2~3割が小児期に発症し、小児の患者数は日本を含めて世界的に増加している。原因不明の疾患であり、一般的に環境要因と遺伝要因が複雑に合わさって発症すると言われている一方で、近年の遺伝学的研究により、若年発症のIBD患者の中には単一遺伝子の変異によって免疫に異常が生じることで発症するIBDが複数報告されており、同センターではその病態解明に注力している。
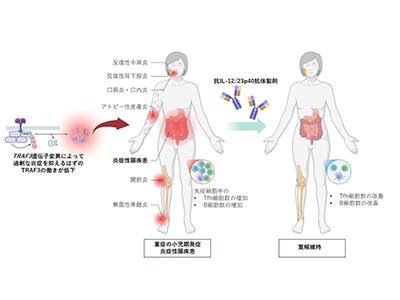
TRAF3は体内に生じた過剰な炎症を制御する機能があり、2022年に初めて自己免疫疾患や免疫不全を引き起こす遺伝性疾患の原因としてTRAF3遺伝子が報告されていたが、IBDとの関連は明らかになっていなかった。
TRAF3変異IBD患者は活動期の免疫グロブリン「高」、抗IL-12/23p40抗体治療で改善
これまでTRAF3変異の症状として報告されている反復性中耳炎・耳下腺炎・アトピー性皮膚炎に加え、重度の口唇炎・口内炎、さらには無菌性骨髄炎を伴う1人の小児IBD患者において全エクソーム解析を実施し、新たにTRAF3の遺伝子変異(p.Pro487Leufs)を同定した。この変異によりTRAF3タンパク質の発現が低下し、末梢血中Tfh細胞の増加を伴う異常な免疫活性が確認された。
この患者ではIBDに対する初期治療として使用されたチオプリン製剤および抗TNFα抗体製剤の効果が乏しく、再燃が繰り返された。しかし、Tフォリキュラー(Tfh)細胞に作用する抗IL-12/23p40抗体による治療により、IBDの持続的な臨床的寛解が得られ、末梢血中のTfh細胞数を含む免疫異常が正常化された。
以上より、TRAF3変異がある患者では、腸炎の活動期に末梢血中の免疫グロブリンの値が異常に高く、免疫グロブリン産生に関与するB細胞とTfh細胞の増加が認められたが、治療によって寛解するとこれらの異常が改善することが判明した。
患者の遺伝情報に基づいた治療アプローチが、IBDの個別化医療実現につながる可能性
今回の研究成果は、TRAF3変異がIBDの発症に寄与する可能性を示した初めての報告であり、若年発症のIBD診断に新たな指針を提供するものと言える。今後、難治性のIBD患者においてTRAF3遺伝子に注目した遺伝子解析が進むことで、TRAF3変異に関連する病態メカニズムが解明されるとともに、適切な治療法が確立されることが期待される。
「本報告によって、患者の遺伝情報に基づいた治療アプローチが、IBDにおける個別化医療提供の実現につながる可能性が示唆された」と、研究グループは述べている。
▼関連リンク
・国立成育医療研究センター プレスリリース



