脳の発達不全・神経細胞の減少などが原因とされる小頭症、詳細な機構は未解明
国立精神・神経医療研究センター(NCNP)は1月15日、大脳皮質の浅層の神経細胞だけが減少することによって引き起こされるという、新しいタイプの小頭症の病態メカニズムを明らかにしたと発表した。この研究は、NCNP神経研究所病態生化学研究部の嶋岡可純リサーチフェロー、星野幹雄部長らの研究グループによるもの。研究成果は、「The EMBO Journal」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
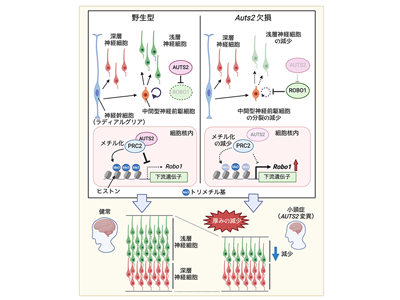
小頭症は、新生児の頭部が小さい状態のことで、特に脳の発達不全や神経細胞の減少などによってもたらされることが多いとされている。哺乳類の脳の発生は胎児期に始まるが、初めのうちは脳室に面した神経幹細胞(ラディアルグリア、RGCとも呼ばれる)が細胞分裂し、大脳皮質の深層神経細胞を生み出す。その後、神経幹細胞は神経細胞ではなく中間神経前駆細胞を生み出し、その中間神経前駆細胞が1回または複数回分裂することによって、浅層神経細胞を生み出す。こうした幹細胞・前駆細胞の分裂回数が減少すると、生み出される神経細胞の数も減少し、小頭症の原因となりうると考えられる。しかしながら、これらの神経幹細胞や中間神経前駆細胞の細胞分裂の回数がいかに適切にコントロールされているのかは未解明の部分が多く、それゆえに小頭症の病態メカニズムも全容解明にほど遠い状況だった。
原因遺伝子の1つAUTS2遺伝子に着目、欠損マウスで浅層神経細胞の減少を確認
AUTS2(Autism Susceptibility Candidate 2)遺伝子はヒトの小頭症の原因遺伝子の1つであり、この遺伝子の働きが損なわれると小頭症以外にも、自閉スペクトラム症や知的障害、ADHD(注意欠如・多動症)、統合失調症、てんかんなどのさまざまな脳神経疾患が併発される。
研究グループは、中間神経前駆細胞におけるAUTS2遺伝子の機能を研究することで、新しいタイプの小頭症の病態メカニズムを発見することに成功した。まず、Auts2遺伝子(ヒトではAUTS2遺伝子、マウスではAuts2遺伝子と表記する)を破壊したAuts2欠損マウスを作製したところ、大脳皮質の深層には大きな影響がないものの、浅層がかなり薄くなることがわかった。免疫染色によって深層神経細胞と浅層神経細胞をそれぞれ別の色で標識すると、Auts2欠損マウスでは、深層神経細胞の数は変わらないのに対し、浅層神経細胞の数が減少しており、結果として大脳皮質の厚みが減少することを見出した。これまでに、大脳皮質の浅層神経細胞の数だけが減少するタイプの小頭症は報告されておらず、AUTS2遺伝子欠損による小頭症は新しいタイプの小頭症であると考えられる。
神経幹細胞は影響ないが、中間神経前駆細胞の細胞分裂が大きく低下
次に、神経細胞を生み出す細胞の数を調べたところ、Auts2欠損マウスでは神経幹細胞も中間神経前駆細胞もその数には変化が認められなかった。しかしながら、それぞれの細胞分裂について調べたところ、Auts2欠損マウスでは、神経幹細胞では細胞分裂に影響がなかったのに対して、中間神経前駆細胞の細胞分裂がかなり低下していることがわかった。このことから、Auts2遺伝子にコードされたAUTS2タンパク質が中間前駆細胞の細胞分裂を促す働きを持つこと、そしてこの機能が失われると中間前駆細胞の細胞分裂が抑制されて浅層神経細胞の数が減少し、小頭症が引き起こされるであろうことが示唆された。
AUTS2タンパク質、Robo1遺伝子抑制を介して中間型神経前駆細胞の分裂を促す
Auts2欠損マウスの結果から、AUTS2タンパク質には中間型神経前駆細胞の細胞分裂を促す働きがあることがわかった。では次に、どのようにしてAUTS2タンパク質はその分裂を促すのか、そのメカニズムを調べた。そこで、正常なマウスとAuts2欠損マウスのそれぞれから、FACSと呼ばれる特殊な方法を用いて中間型神経前駆細胞だけを集めてきて、それぞれの細胞内で発現する遺伝子を調べた。すると、Auts2欠損マウスでは、脳神経系の発達に関わるさまざまな遺伝子発現が上昇していることがわかった。それらの遺伝子の中で、研究グループはRobo1遺伝子(と、そこから作られるROBO1タンパク質)に着目した。実際に、子宮内電気穿孔法という特殊な方法でRobo1遺伝子をマウスの中間前駆細胞で過剰に発現させると、中間前駆細胞の細胞分裂が抑制されることがわかった。逆に、Auts2欠損マウスで発現上昇したRobo1遺伝子の働きを、ノックダウンという方法で抑えると、中間前駆細胞の分裂が正常に回復することも認められた。これらのことから、Auts2欠損マウスの中間型神経前駆細胞では、Robo1遺伝子が過剰に働くことで、細胞分裂が抑えられ、結果として浅層の神経細胞が減少し、小頭症が引き起こされる、ということがわかった。
PRC2と協働しRobo1などのヒストンをメチル化、遺伝子発現を抑制する機構を解明
次に、AUTS2タンパク質がどのようにして、Robo1などの遺伝子の発現を抑えるのかについて調べた。遺伝子(DNA)には、数種類のヒストンという特殊なタンパク質が巻きついている。遺伝子発現は、ヒストンタンパク質のメチル化やアセチル化といった化学修飾によって、調節されていることが知られている。研究グループは、そのようなヒストンタンパク質の修飾を調べるさまざまな実験を行い、AUTS2タンパク質が、ポリコーム複合体2(PRC2)という特殊なタンパク質複合体と協働し、特にRobo1などの神経系の発生に関わる遺伝子のヒストンのメチル化(正確にはH3K27トリメチル化)に働き、その遺伝子の発現を抑制することを見出した。今回の研究により、AUTS2によるヒストン・メチル化修飾機構と、それによる遺伝子発現抑制機構が初めて明らかにされた。
新たな小頭症の病態メカニズムを解明、創薬標的など治療法の開発に期待
今回の研究から、AUTS2遺伝子の機能が失われると小頭症が引き起こされるのか、その発症メカニズムが明らかとなった。AUTS2機能欠損では、中間神経前駆細胞の細胞増殖が抑制され、浅層神経細胞の数が減少するために、小頭症が引き起こされる。このようなタイプの小頭症はこれまでに報告されておらず、今回の研究から新たな小頭症の病態メカニズムが明らかにされた。「今後は、ROBO1や、PRC2の構成タンパク質を創薬のターゲットとした研究を推進し、AUTS2の機能欠損による小頭症や知的障害などの新たな治療法の開発に努めていきたいと考えている」と、研究グループは述べている。
▼関連リンク
・国立精神・神経医療研究センター プレスリリース



