世界的に開発が進むウイルス療法、遠隔腫瘍への治療効果には課題
鳥取大学は11月28日、ウイルスを投与した部位だけでなく、遠隔に位置する転移がんに対しても高い治療効果を示す「次世代がん治療用ワクシニアウイルス」の開発に成功したと発表した。この研究は、同大医学部ゲノム再生医学講座ゲノム医療学分野の中村貴史教授、中武大夢助教、黒崎創講師、板谷華大学院生(研究当時)らの研究グループによるもの。研究成果は、「Molecular Therapy」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
ウイルス療法は、正常細胞は傷害せず腫瘍のみを標的破壊するように改良したがん治療用ウイルスを抗がん剤として用いる新しいがん治療法であり、2015年の米国でのがん治療用ウイルス薬の承認を皮切りに、世界中で研究・開発競争が激化している。ウイルス療法の作用機序は、第一にウイルスが感染したがん細胞・組織内で増殖伝播することによって直接腫瘍を溶解する。第二にそれに伴って抗腫瘍免疫応答が賦活化され全身に治療効果を発揮する。
この多様な作用機序により、がん治療用ウイルスを腫瘍内に投与する局所療法が、抗腫瘍免疫応答を賦活化し、遠隔に位置する転移がんに対しても全身性に治療効果を発揮する画期的ながん治療法であると言える。これまで研究グループは天然痘のワクチンに由来するワクシニアウイルスを基に、ウイルスの持つ細胞増殖促進因子を欠損させることで正常細胞でのウイルス複製を抑制し、がん細胞でのみ複製することを可能としたがん治療用ワクシニアウイルスMDRVV、ならびにMDRVVから単離され、細胞融合作用により強力な抗がん作用をもたらす新たな治療用ウイルスFUVACの独自開発に成功してきた。両側皮下担がんモデルマウスにおいて、FUVACの細胞融合作用は投与した腫瘍の溶解作用を高めるのみでなく、投与局所での免疫抑制環境を改善し、さらに全身への細胞傷害性T細胞の浸潤を促すことで、効果的に抗腫瘍免疫応答を引き起こすことがわかっている。しかしながら、ウイルスが直接行き渡らない遠隔腫瘍への治療効果はウイルスによる直接作用を欠いてしまうため、投与局所と比較するとその効果が弱まり、遠隔のがんを完全に退縮させるには至らなかった。
2つの免疫制御遺伝子を搭載、マウス実験のCR率は72%で非投与側腫瘍にも有効
そこでこの研究では、FUVACにさまざまな免疫制御遺伝子を搭載発現させた武装化FUVACを作製し、マウス大腸がんCT26細胞を両側の皮下に移植した担がんマウスモデルにおいて、単独およびそれらの組み合わせによる抗がん効果を評価した。
その結果、NK細胞やT細胞の活性化を誘導するIL-12と樹状細胞やT細胞を誘引するCCL21を同時に搭載発現させた武装化FUVAC-IL-12/CCL21(FUVAC121)の片側腫瘍への単回投与は、FUVACでは見られない投与側と非投与側の両方の腫瘍を完全寛解(CR)させ、そのCR率は72%に達した。それに対して融合しないMDRVVにIL-12とCCL21を搭載発現させたMDRVV-IL-12/CCL21では、両方の腫瘍のCR率が29%だった。即ちFUVAC121では、細胞融合能と2つの免疫制御遺伝子発現、特にIL-12とCCL21の組み合わせの両方が極めて高い抗がん効果に寄与していることがわかった。
腫瘍浸潤リンパ球増加、疲弊T細胞は減少しエフェクターメモリーT細胞を動員
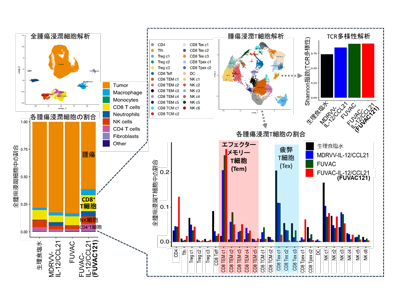
この作用機序を解明すべく、治療7日目のウイルス非投与腫瘍を回収し、シングルセルRNAシークエンス解析を行った。
その結果、PBS、FUVACおよびMDRVV-IL-12/CCL21に比べFUVAC-IL-12/CCL21では、がん細胞が減少し、腫瘍浸潤リンパ球(TILs)が増加してColdからHot腫瘍へ変わっていた。注目すべきはFUVAC-IL-12/CCL21によってCD8陽性T細胞の腫瘍への浸潤が高まっており、特にCD8陽性T細胞の中で疲弊T細胞(Tex細胞)が減少し、エフェクターメモリーT細胞(Tem)が動員されていた。またT細胞受容体(TCR)レパトア解析の結果より、FUVAC-IL-12/CCL21はCD8陽性T細胞がもつTCRの多様性を増加させた。
一方、治療7日目の脾細胞を回収し、マイトマイシン処理した腫瘍細胞、またはUV不活化したワクシニアウイルスによる刺激後のIFN-γELISA試験を行った。その結果、ウイルス反応性T細胞ではなく腫瘍反応性T細胞の誘導が確認され、がん特異的な免疫応答が優位になっていた。
免疫チェックポイント阻害薬抵抗性腫瘍、FUVAC121併用で5匹中1匹が完治
さらに、FUVAC121治療によるエフェクターメモリーT細胞の動員やその多様化は、免疫チェックポイント阻害薬抵抗性の腫瘍を応答性に変えることが期待された。そこで、抗PD-1抗体治療に高い抵抗性を示すマウス膵臓がんPan02腹膜播種モデルマウスにおいて、FUVAC121と抗PD-1抗体の腹腔内投与による併用効果を検討した。
その結果、免疫制御遺伝子を搭載していないFUVACでは単独でも抗PD-1抗体との併用投与でも十分な延命効果は得られなかったのに対し、FUVAC121は単独でも有意な生存延長を示したのみでなく、抗PD-1抗体との併用では5匹中1匹のマウスで腹膜播種した腫瘍を完治させるさらなる延命効果が得られた。
FUVAC121、局所治療から5段階で全身の抗腫瘍効果を実現
以上よりFUVAC121は、1)ウイルスを投与した腫瘍内において細胞融合が免疫応答のトリガーとなるとともに、IL-12とCCL21の産生が起こることでその免疫応答がブーストされ、2)細胞融合により多くの腫瘍抗原が放出されたことを受けてリンパ組織において多様な腫瘍抗原を標的とするT細胞が誘導され、3)特にT細胞の中でも若く高活性状態にあるエフェクターメモリー型のT細胞が増員されることで、4)通常役割を終えた疲弊状態にあるT細胞が優位となるウイルス非投与側腫瘍内の腫瘍微小環境を改善し、5)免疫チェックポイント阻害薬抵抗性の腫瘍を応答性に変えることで併用効果を最大化し、腫瘍を完全寛解させる極めて高い治療効果を発揮した。
抗腫瘍免疫が不十分な患者に対する解決策としても期待
研究グループは次世代がん治療用ワクシニアウイルスFUVAC121の早期実用化を目指し、さまざまな難治性がんの担がんモデルマウスにおいてFUVAC121の有効性と安全性を実証しながら、アカデミアにおいて大きなハードルとなる製造課題の克服にも取り組んでおり、ベンチサイドからベッドサイドへの橋渡し研究を推進していくとしている。
「免疫チェックポイント阻害薬は標準療法では治癒できないような難治性の進行がんに対しても優れた効果を示すが、抗腫瘍免疫が十分に誘導されていない患者には効果が認められない。FUVAC121との併用はこの問題を解決する1つの手段となることが期待される」と、研究グループは述べている。
▼関連リンク
・鳥取大学 プレスリリース



