運動神経変性の原因となるタンパク質凝集体形成、相分離の制御因子が関与か
奈良県立医科大学は10月9日、転写因子に広く見られるジンクフィンガードメイン(ZnF)が、筋萎縮性側索硬化症(ALS)病態に関わる生物学的相分離(以下、相分離)の調節因子として機能することを明らかにしたと発表した。この研究は、同大未来基礎医学の森英一朗准教授、脳神経内科学の杉江和馬教授、徳島大学の齋尾智英教授、東北大学の青木正志教授らの研究グループによるもの。研究成果は、「Nature Communications」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
ALSは、運動神経が変性し、筋萎縮・筋力低下や構音・嚥下障害が進行する神経難病である。症状の原因となる運動神経の変性過程では、タンパク質が集まってできる凝集体が細胞内に蓄積している。近年、遺伝性ALSを含む研究の進展により、細胞内で起こる相分離という現象が、ALSの病態に重要な役割を果たすことが示唆されている。
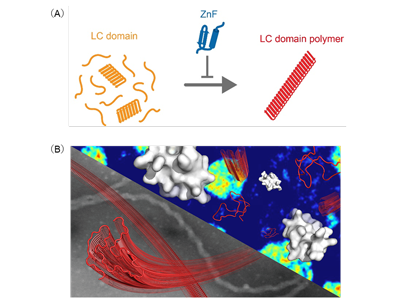
相分離によって細胞内の分子は自発的に仕切られ、ストレス顆粒などの膜をもたない小器官が形成される。これらの内部では、数種類のアミノ酸で構成される低複雑性(low-complexity; LC)ドメインをもつRNA結合タンパク質が多数の弱い相互作用を組み合わせて集まり、LCドメインポリマーというLCドメイン同士が繰り返し結びついて線維状の多量体の状態となって可逆的に機能する。ところが相分離の制御が破綻すると、可逆的なポリマー状態はアミロイド様に線維化し、不可逆的な凝集体の形成・蓄積につながると考えられている。相分離の制御因子としては、これまで核内輸送受容体などの分子が関与することが報告されているが、いまだ不明な点が多く残っており、特にLCドメインに対する認識・制御機構の解明は大きな課題となっている。
転写因子に広く見られるZnFに着目、LCドメインとの特異的結合能力が判明
そこで研究グループは、遺伝性ALSの運動神経モデルや血管内皮細胞の虚血モデルでの遺伝子解析から得られた知見を手掛かりに、転写因子に広く見られるZnFに着目し、ZnFのLCドメイン認識および、形成や性質に与える影響を解析した。
今回の研究では、まず遺伝性ALSの運動ニューロンや血管内皮細胞の虚血モデルでの遺伝子解析を行い、それらの細胞モデルではKLF4やZnFを含むタンパク質が関与していることがわかった。ZnFと相分離との関係性を明らかにするため、ヒドロゲルを用いた生化学的評価を行うと、KLF4の各ドメインの中でもZnFのみがLCドメインと結合すること、またDNA結合ドメインの中でもZnFのみがLCドメインと結合することがわかった。KLF4以外のDNA結合タンパク質のZnFも同様にLCドメインと結合し、またZnFはhnRNPA2やFUS、TDP-43などのさまざまなLCドメインのヒドロゲルと結合することが明らかになった。
ZnFは多様なLCドメインと共通の様式で結合、DNA結合とは異なる様式
次に核磁気共鳴(NMR)装置により、ZnFとLCドメインの相互作用部位を詳細に解析した。まず、安定同位体で標識したZnFのNMRスペクトルを取得した。ZnFにLCドメインを加えた際のスペクトルを観察すると、異なるRNA結合タンパク質のLCドメインとは、共通して変化するピークが見られた。これにより、ZnFは異なるLCドメインに対しても同様の結合様式を持っていると考えられた。また、ZnFはDNA結合ドメインであり、DNAと強固に結合することがわかっている。そこで、DNAを加えた際のスペクトルを比較したところ、LCドメインを加えた際とは変化するピークが異なることが判明した。このことから、ZnFはDNA結合とは異なる様式でLCドメインと結合することが判明した。
相分離液滴内において、ZnFが取り込まれポリマー化を抑制する機構が明らかに
続いて、相分離でできるRNA結合タンパク質の小さな液滴を使って、ZnFが液滴の性質に与える影響を調べた。まず顕微鏡観察では、ZnFを含まない条件に比べ、ZnFはより多く液滴内に取り込まれる様子が観察された。次に、液滴の屈折率(RI)を測る方法で中身の濃さを可視化すると、ZnFを加えると液滴内部の屈折率が下がり、より疎になることがわかった。画像を定量しても同じ傾向が確認された。加えて、Thioflavin Tという蛍光色素でLCドメインが硬い線維状へ伸びていく過程を追跡すると、ZnFの存在下ではLCドメインのポリマー化が観察されなくなった。つまり、ZnFはLCドメインポリマーに結合すると同時に、ポリマー化を抑制する働きを示した。
LCドメインのポリマー化しにくくなる変異に対し、ZnFの結合は弱まる
さらに、RNA結合タンパク質であるhnRNPA2のLCドメインに、ポリマー化しにくくなる変異を入れた試料を用いて、ZnFとの結合強度を比べた。通常のLCドメインは時間とともにポリマーを形成し、電子顕微鏡でも細い線維状の構造が確認できる。ところが、ポリマー化しにくい変異体では、この線維ができにくく、ゲルろ過クロマトグラフィーでも小さな状態のまま検出され、Thioflavin Tを使った測定でも硬い線維へ進むスピードが明らかに遅くなった。こうしたポリマー化しにくい変異体に対しては、ZnFの結合が弱まることが、ヒドロゲル結合実験やNMRのシグナル変化からわかった。これらの結果から、ZnFはLCドメインに結合し、特にポリマー化した状態をより特異的に認識し結合していることが判明した。
DNA結合タンパク質として知られるZnF、相分離制御因子としての新たな役割を発見
今回、生化学的、細胞生物学的実験や、物理化学的解析などの幅広い手法を統合的に用いて、ZnFとLCドメインとの関係、ZnFが相分離に及ぼす影響を明らかにした。ZnFは古くからDNA結合タンパク質として知られてきたが、これまでRNA結合タンパク質や相分離との直接的な関係は十分にわかっていなかった。今回の研究では、ZnFの新たな役割として、LCドメインとの結合、特にLCドメインポリマーを選択的に認識して、伸長に抑制的に働く、というモデルが提唱された。
「これまで転写因子のDNA結合ドメインとして知られていたZnFに、相分離制御因子としての新たな可能性を見出した今回の研究成果から、ALSを始めとする神経変性疾患の病態解明、新たな治療法開発につながることが期待される」と、研究グループは述べている。
▼関連リンク
・奈良県立医科大学 プレスリリース



