ヒトの腸管で炎症の有無にかかわらず、sPLA2-IIAが常に高発現している理由は?
東京大学は1月26日、腸管内腔に分泌されるリン脂質分解酵素の一つであるIIA型分泌性ホスホリパーゼA2(sPLA2-IIA)が、腸内細菌叢のバランスを変えることによって、皮膚がんや乾癬などの皮膚疾患に影響を及ぼすことを発見したと発表した。この研究は、同大大学院医学系研究科の村上誠教授らの研究グループと、慶應義塾大学薬学部の有田誠教授、同先端生命科学研究所の曽我朋義教授、医薬基盤健康栄養研究所の國澤純プロジェクトリーダーらとの共同研究によるもの。研究成果は、「JCI insight」オンライン版に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
昨今、腸内細菌叢の変容が宿主の全身の健康状態に大きな影響を及ぼすことが注目されている。ある種の腸内細菌が産生する代謝物は、全身の免疫・代謝・神経系などの調節に深く関わる。これまでに、いくつかの宿主側の因子(その多くは抗菌活性を有するペプチドや腸内免疫の調節に関わる因子)が腸内細菌叢の制御に関わることが報告されているが、その全体像は十分に解明されていない。村上教授らの研究グループは、長年にわたり脂質の代謝に関わる酵素群の研究を行ってきた。
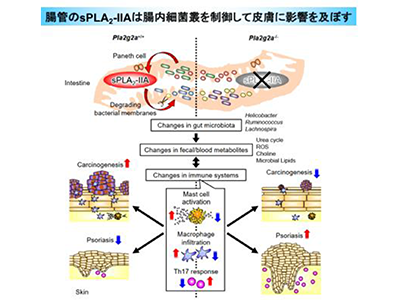
sPLA2ファミリーは、細胞外に分泌されるリン脂質分解酵素の一群で、そのうちの一つ「sPLA2-IIA」は、1980年代後半に発見され、最も古くから研究されているsPLA2分子種。ヒトにおいて、sPLA2-IIAは炎症時に様々な組織中に発現誘導されることから、これまでにその機能として、発現局所において脂質メディエーターの産生を介して炎症に関わる可能性や、感染細菌の膜リン脂質を分解することで生体防御に関わる可能性などが提唱されてきた。例外的にヒトの腸管には炎症の有無にかかわらず、sPLA2-IIAが常に高発現しているが、その生理的意義は不明だった。特定のタンパク質の生体内での機能を調べるためには、その遺伝子を欠損(ノックアウト)したマウスの解析が極めて有用であり、C57BL/6系統のマウスが広く用いられている。しかし、C57BL/6系統のマウスはsPLA2-IIA遺伝子に先天的な変異を持ち、sPLA2-IIAを発現していないため、C57BL/6マウスを用いた通常のノックアウト技術は適用できず、sPLA2-IIAの機能を調べることができなかった。そのため、sPLA2-IIAの生体内機能の解析にはsPLA2-IIA過剰発現(トランスジェニック)マウスが利用されてきた。
sPLA2-IIA欠損マウスの小腸では免疫グロブリン遺伝子の発現が大きく変化
研究グループは今回、BALB/c系統のマウスが正常のsPLA2-IIA遺伝子を持つ点に着目し、この系統でsPLA2-IIA遺伝子をノックアウトした。多くの組織でsPLA2-IIAの発現が見られるヒトとは異なり、野生型のBALB/cマウスではsPLA2-IIAは腸管(小腸>大腸)にほぼ限局して発現していたという。こうした組織分布に関する動物間種差は、しばしば問題となるが、見方を変えれば、sPLA2-IIAを欠損させたBALB/cマウスは、腸管に恒常的に高発現しているsPLA2-IIAの機能を調べるには絶好の解析ツールと言える。
村上教授らはこれまでに、sPLA2ファミリーの全ての分子種のノックアウトマウスを網羅的に作製し、表現型の比較解析を進めてきた。その過程で、sPLA2-IIAノックアウトマウスでは皮膚がんができにくい一方で、乾癬が悪化しやすいことを見出した。しかし、上述のように、BALB/cマウスではsPLA2-IIAは腸管のみに発現しており、皮膚や免疫系を含む、腸管以外の組織では痕跡程度しか検出できないため、なぜ皮膚に表現型が顕在化するのかが不明だった。小腸において、sPLA2-IIAはさまざまな抗菌ペプチドを分泌するパネート細胞に発現しており、抗生物質の投与によりその発現が大きく低下する。このことから、sPLA2-IIAは腸内細菌成分により発現誘導され、抗菌ペプチドの一つとして腸内細菌の膜リン脂質を分解して腸内細菌叢のバランスを変えることで、二次的に皮膚に影響を及ぼしている可能性を想定した。
実際に、sPLA2-IIAノックアウトマウスと野生型マウスの腸内細菌叢を比較解析すると、ノックアウトマウスでは属レベルで一部の腸内細菌(Helicobacter, Ruminococcus, Lachnospira属など)に明らかな相違が見られた。sPLA2-IIAノックアウトマウスと野生型マウスを出生時から同居飼育(co-housing)すると、互いに食糞する結果、両群の腸内細菌叢に違いが見られなくなり、野生型マウスとノックアウトマウスの皮膚の表現型の差が消失した。また、ノックアウトマウスの小腸では、腸管の免疫や上皮バリアに関わる遺伝子群の発現に変化が見られ、特に腸内細菌叢の違いを反映して免疫グロブリン(抗体)遺伝子の発現が大きく変化していた。
sPLA2-IIAの欠損による腸内細菌叢の変化が、皮膚の疾患に二次的影響を及ぼす
さらに、ノックアウトマウスでは野生型マウスと比べて19の血漿成分に有意な変化がみられ、その中には免疫調節やがん化に関わるものも含まれていた。糞便中の脂質を網羅的に分析した結果、ノックアウトマウスでは宿主ではなく腸内細菌に固有に存在する脂質成分が有意に減少していた。さらに、よりクリーンな飼育環境で飼育すると、野生型マウスの腸管においてHelicobacterやRuminococcusなどの腸内細菌が減少し、その結果、sPLA2-IIAの発現量が低下することで、野生型マウスとノックアウトマウスの間で腸内細菌叢に違いが見られなくなり、それと同時に皮膚の病態に差が認められなくなった。
研究グループは以上の結果から、小腸パネート細胞から分泌されるsPLA2-IIAは腸内細菌叢の調節に関わり、この経路が遮断されると腸内細菌叢に変容が生じ、二次的に遠隔の皮膚に表現型が顕在化すると結論付けた。
腸管のsPLA2-IIAが、皮膚疾患の新たな創薬標的・予測バイオマーカーとなる可能性
今回の研究成果により、長年不明だったsPLA2-IIAの腸管における機能を初めて明らかにされた。腸管にはsPLA2-IIA以外のsPLA2分子種も発現していることから、これらも同様に腸内細菌叢の制御を介して遠隔臓器に影響を及ぼしている可能性があり、今後はこれを証明し、理論を一般化することが必要だ。
「ヒトとマウスではsPLA2-IIAの発現分布に違いがあるが、腸管に高発現している点については共通していることから、ヒトにおいても腸管のsPLA2-IIAは腸内細菌叢の調節に関わっていることが予想される。このことから、腸管のsPLA2-IIAを標的とした創薬は、皮膚疾患の新たな診断や治療に役立つ可能性が期待できる」と、研究グループは述べている。
▼関連リンク
・東京大学 プレスリリース



