アルツハイマーなどの神経疾患、可溶性タウの過剰により不溶性の神経原線維変化を形成
沖縄科学技術大学院大学(OIST)は6月22日、アルツハイマー病に関わるタンパク質で、微小管に結合するタウ・タンパク質が、マウスの脳内でシナプス間の信号伝達を低下させることを明らかにしたと発表した。この研究は、同大細胞分子シナプス機能ユニットの高橋智幸教授らの研究グループによるもの。研究成果は、「eLife」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
神経細胞で生成されるタウ・タンパク質は、細胞の構造を保ち細胞内の物質の輸送経路としても使われる細長いフィラメント(筒状の線維)である微小管に結合し、集合体を形成する「重合」に役立つ。通常、タウ・タンパク質は、微小管に結合した状態で存在するか、細胞の中を埋める液体中に溶けこんでいる。しかし、特にアルツハイマー病などの一部の神経疾患では、溶けやすい「可溶性タウ・タンパク質」の濃度が脳の特定部位で過剰になり、凝縮して溶けにくい不溶性の「神経原線維変化」と呼ばれる構造を形成する。
マウスのシナプス前末端に可溶性タウ注入で、多くの微小管が新たに重合
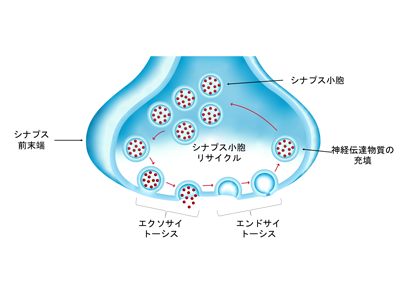
研究グループは、哺乳類の脳で最大のシナプスであるHeldの萼(ヘルドのがく)状シナプスで行われる信号伝達に、高濃度の可溶性タウ・タンパク質が及ぼす影響を調べた。シナプスでは、2つの神経細胞が接触して通信を行う。電気信号がシナプス前細胞の末端に到達すると、「小胞」と呼ばれる膜の袋から「神経伝達物質」と呼ばれる化学物質が神経細胞間の間隙に放出される。神経伝達物質がシナプス後細胞に到達すると、新たな電気信号が作られる。
マウスのHeldの萼状シナプスの前末端に可溶性タウ・タンパク質を注入したところ、シナプス後細胞での電気信号の生成が劇的に低下することを発見した。その後、タウ・タンパク質と微小管を蛍光標識して観察したところ、タウ・タンパク質を注入するとシナプス前末端内で多くの微小管が新たに重合することを確認した。しかし、微小管の重合に関わる結合部位を欠いた変異型のタウ・タンパク質を代わりに注入すると、シナプスの信号伝達には影響がみられなかった。
タウ過剰により高周波信号伝達のみ低下、低周波に変化なし
さらに、第二の重要な手がかりとして、タウ・タンパク質の増加によって低下するのが高周波信号の伝達のみであり、低周波信号の伝達は変化しないことが明らかになった。高周波信号は、一般に認知や運動の制御に関わるものである。研究グループは、このように高周波伝達にのみ選択的に影響が出る理由として、シナプス小胞のリサイクルが阻害されているためではないかと推測した。
シナプス小胞のリサイクルは、シナプス伝達における非常に重要なプロセスである。シナプス小胞はシナプス前末端の膜と融合して伝達物質を「エクソサイトーシス(開口放出)」した後、「エンドサイトーシス(膜回収)」によって再形成され、神経伝達物質を再充填して、開口放出に再利用されるためだ。シナプス小胞のリサイクルのいずれかの過程が阻害されると、多数の小胞開口を必要とする高周波信号はすぐに弱まってしまう。
可溶性タウ過剰によるエンドサイトーシス阻害を発見
そして、研究グループは、可溶性タウ・タンパク質の濃度が上昇すると、最初にエンドサイトーシスが阻害されることを見出した。小胞が再形成されないとリサイクリングが損なわれ、二次的な影響によって、エクソサイトーシスが低下することになる。
さらに、「ノコダゾール」という微小管の新たな重合を阻害する薬剤を使用することで、注入したタウ・タンパク質によるエンドサイトーシスの低下を防ぐことができるという重要な発見をした。
ダイナミンの微小管結合増加によりエンドサイトーシス阻害
次に、微小管の量が過剰になることでエンドサイトーシスが阻害される詳しいメカニズムの解明に取り組んだ。微小管とエンドサイトーシスの関連を探る中で、エンドサイトーシスの最終段階で小胞を表面の膜から切り離す役割を果たす大型のタンパク質「ダイナミン」が、実は微小管に結合するタンパク質として発見されていたことに気がついた。しかし、その結合部位については、ほとんど何も明らかになっていなかった。
タウ・タンパク質、微小管、ダイナミンを蛍光標識して観察したところ、タウ・タンパク質を注入したシナプス前末端では、ダイナミンの結合が増加しており、エンドサイトーシスにおける役割を果たせなくなっていることが判明した。
ダイナミン部分ペプチド「PHDP5」投与でシナプス伝達がほぼ正常
そこで、ダイナミンと部分的にアミノ酸配列が一致するペプチドを多種類合成し、これらのペプチドがダイナミンと微小管の結合を阻害することによって、タウ・タンパク質によるシグナル伝達の障害を防ぐことが可能かどうかをテストした。その結果、ダイナミン部分ペプチドのひとつ「PHDP5」をタウ・タンパク質と共に注入したところ、エンドサイトーシスとシナプス伝達がほぼ正常な状態に保たれることが確認された。
PHDP5がアルツハイマー病の有効な治療法となる可能性
今後、研究グループは、可溶性タウ・タンパク質の濃度が高いアルツハイマー病のモデルマウスにこのペプチドを投与する実験を行う予定。これらのマウスは、生後6~8か月頃に学習能力や新しい記憶の形成能力が低下するが、このペプチドを投与することによって記憶障害の予防、または回復が可能となることが期待される。
研究グループの高橋教授は次のように述べている。「多くの研究者は、アルツハイマー病の目に見える特徴である神経原線維の塊が及ぼす影響に注目しているが、認知機能の低下と最も密接な相関があるのは、実は目に見えない可溶性タウと考えられる。今後PHDP5を改変して、血液から脳組織への移行を制限する「血液脳関門」を通過できるようにする必要がある。このペプチドの有効性がモデルマウスで確認されれば、アルツハイマー病の有効な治療法となる可能性がある」。
▼関連リンク
・沖縄科学技術大学院大学(OIST) プレスリリース



