プロテアソーム関連自己炎症症候群は病態メカニズムがほとんど不明
岐阜大学は12月1日、プロテアソームサブユニットβ1iをコードする遺伝子(PSMB9)のde novoの新規のヘテロ接合性アミノ酸置換バリアントにより、免疫不全を伴うプロテアソーム関連自己炎症症候群という新たなタイプの遺伝性疾患が生じることを見出し、その病態を再現する新規のモデルマウスを樹立したと発表した。この研究は、同大医学系研究科小児科学分野の大西秀典氏、和歌山県立医科大学先端医学研究所の改正恒康氏、邊見弘明氏(現在岡山理科大学獣医学部)、同大学皮膚科学の金澤伸雄氏(現在兵庫医科大学皮膚科学)、琉球大学小児科の金城紀子氏、長崎大学原爆後障害医療研究所の吉浦孝一郎氏、東京大学大学院薬学系研究科の村田茂穂氏、兵庫県立大学大学院理学研究科の水島恒裕氏らの研究グループによるもの。研究成果は、「Nature Communications」に掲載されている。
画像はリリースより
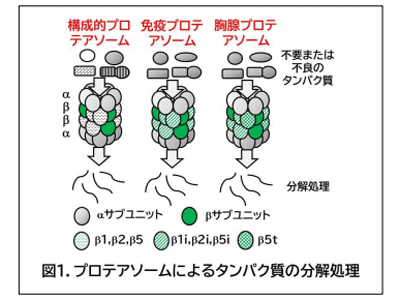
プロテアソームは、不要になったり、うまく合成されなかったりしたタンパク質を分解処理することにより、細胞、組織の恒常性維持に必須の役割を果たすタンパク質複合体であり、7個のαサブユニット(α1~7)、7個のβサブユニット(β1~7)がリング状に結合することにより構成されている。
近年、これらのサブユニットをコードする遺伝子のバリアントが、周期性の発熱、皮疹、進行性の脂肪筋肉萎縮を来し、自己炎症性疾患の原因となることが明らかとなり、プロテアソーム関連自己炎症症候群(Proteasome-associated autoinflammatory syndrome、PRAAS)と総称されている。PRAASの病態については、炎症性サイトカインであるIL-6やI型インターフェロンの過剰産生などが生じていることが指摘されているが、適切なモデルマウスがなく、プロテアソームの機能障害によりどのような機構で病態が生じるのかについてはほとんど不明であり、有効な治療法も確立されていない。
新生児期にPRAAS様炎症を起こすが通常見られない病態を示す独立した2症例を発見
周期性かつ難治性のPRAAS様の炎症症状を新生児期に発症しながらも、通常のPRAASに認められる脂肪萎縮を示さず、また、PRAASではほとんど認められない肺高血圧やリンパ球減少(獲得免疫不全)を示す独立した2症例(琉球大学小児科、岐阜大学小児科)が見つかった。
PSMB9遺伝子にde novoの新規のヘテロ接合性バリアントG156D
そして、詳細な遺伝子解析により、どちらの患者においても、プロテアソームサブユニットβ1iをコードする遺伝子(PSMB9)にde novoの新規のヘテロ接合性バリアント(β1iの156番目のアミノ酸であるグリシンをアスパラギン酸に置換させるバリアント、G156D)が病態の原因として有力な候補であることが示唆された。また、立体構造の推定解析により、この遺伝子バリアントがプロテアソームの構造に障害を来すことも示された。さらに、患者由来の細胞を解析したところ、β1iのタンパク質が十分成熟せず、プロテアソームの構造および機能が障害されていた。
G156Dヘテロ変異マウスを作製、病態の再現に成功
次に、G156Dの病理的意義を明らかにするため、CRISPR/Cas9法により、G156D変異をマウスに導入し解析したところ、G156Dヘテロ変異マウスにおいて、患者由来の細胞での所見と同様のパターンで、β1iタンパク質の成熟、プロテアソームの構造および機能が障害されていた。また、G156Dヘテロ変異マウスを免疫学的に解析したところ、獲得免疫については、胸腺が萎縮するとともに、脾臓ではT細胞とB細胞いずれのリンパ球も減少し、抗体(免疫グロブリン)産生も顕著に低下しており、自然免疫については、樹状細胞が減少している一方で、好中球や単球は増加していた。G156Dヘテロ変異マウスに認められたプロテアソーム障害、免疫異常の表現型は、同変異を有する患者の所見と共通する部分が多く、G156D変異が患者の病態の原因であることが強く示唆された。
新規の疾患概念「PRAAS-ID」を提唱
以上のように、新生児期に免疫不全を伴う自己炎症性疾患を発症した独立した日本人患者2症例に共通して、プロテアソームサブユニットβ1iのアミノ酸置換を来す、新規のヘテロ接合性遺伝子バリアント(G156D)が病態の原因であることが見出された。このバリアントは、これまでのPRAASと異なり、単一遺伝子のヘテロ接合性バリアント、すなわち常染色体顕性(優性)遺伝様式である点がユニークであると言える。また、これまでのPRAASの原因となる遺伝子バリアントは、主に、プロテアソームのタンパク質分解酵素の活性中心の構造に影響を及ぼし、構造異常と共に顕著な活性低下を来すのに対し、β1i G156Dバリアントでは、プロテアソームのリング構造への影響が主で、タンパク質分解酵素の活性中心の構造は保持され、プロテアソーム活性は障害されているもののユビキチンの蓄積がほとんど見られないという特徴を有する。さらに、臨床所見においても、これまでのPRAASと比較して、脂肪萎縮を示さず、肺高血圧が顕著で、獲得免疫不全が認められるなどの相違点が認められる。
以上の点から、今回同定されたβ1i G156Dバリアントは、PRAASと似て非なる病態を引き起こしている可能性が強く示唆され、研究グループは、免疫不全を伴う自己炎症性疾患(PRAAS with immunodeficiency、PRAAS-ID)という新規の疾患概念を提唱した。
プロテアソーム関連疾患の解明に期待
また、これまでPRAASの病態を再現するモデルマウスは報告されていなかったが、同研究で樹立したβ1i G156D変異マウスでは、プロテアソームの障害パターン、免疫異常など、患者の所見が再現された。
プロテアソームの機能異常は老化、神経変性疾患、難治性腸炎、がんなどさまざまな病態にも認められる。「β1i G156D変異マウスの解析を進めることにより、プロテアソーム関連自己炎症症候群、免疫不全に加えて、プロテアソームの機能異常を来すさまざまな病態のメカニズムが解明され、新たな制御手段、治療法の開発が進むことが期待される」と、研究グループは述べている。
▼関連リンク
・岐阜大学 研究成果








