米マサチューセッツ州ダンバース

(ビジネスワイヤ) — Restore EF試験により、 Impella補助下の高リスクPCIでより完全な血行再建を試みたケースを含め、最新のベストプラクティスの使用が、フォローアップ時における左室駆出率(LVEF)、心不全の症状、狭心症の症状の有意な改善をもたらすことが示されました。研究の中間解析結果は、心臓血管研究財団の第32回年次科学シンポジウムであるTCTコネクトで、UCサンディエゴ・ヘルスのインターベンション心臓専門医であるMitul Patel医師(MD)が発表しました。
本プレスリリースではマルチメディアを使用しています。リリースの全文はこちらをご覧ください。:https://www.businesswire.com/news/home/20201021006161/ja/
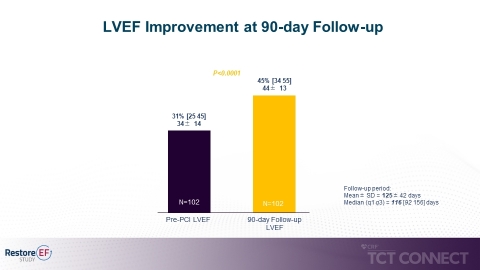
図1(画像:ビジネスワイヤ)
本研究は進行中の多施設前向き単群研究で、地方、都市部、コミュニティー、学術センターを含むさまざまな施設を含む米国の19病院で2019年9月から2020年9月の間に、ImpellaによるProtected PCIを受けた193例の連続した研究適合患者を組み入れました。中間解析下記の結果が示されました。
- ベースラインから90日間のフォローアップでのLVEF中央値の有意な改善(31%から45%、p<0.0001)を認めました。90日時点のLVEF改善は本研究の主要評価項目です(図1参照)。
- 心不全症状は有意に低減し、ニューヨーク心臓協会(NYHA)分類III~IV度がフォローアップ時点で80%低減しました(54%から11%、p<0.001)。(図2参照)
- 狭心症症状も有意に低減し、カナダ心臓血管学会(CCS)分類III~IV度がフォローアップ時点で99%低減しました(70%から1%、p<0.0001)(図3参照)。
Patel医師は、次のように述べています。「Restore EFでは、Impella補助下PCIを受けた患者が90日時点でLVEFの有意な改善を示すことが示されました。また、本研究ではNYHAおよびCCSの各機能分類により評価した心不全および狭心症の各症状の有意な改善が認められました。総合的に考えると、これらのデータは、単一条件での完全な血行再建を達成するためのImpellaの使用を含め、高リスクPCI患者を治療するためのベストプラクティスが持つ有効性が確認されたことを示しています。」
プロビデンス・ヘルス・アンド・バスキュラー・インスティチュートのインターベンション心臓専門医でRestore EF研究の共同主任研究者を務めるJason Wollmuth医師は、次のように述べています。「高リスクPCI患者は多くの場合、合併症、左室機能の低下、血行動態の悪化が原因で、血行再建に課題を抱えた結果、転帰が悪化する可能性があります。本研究は、高リスクPCIの際に、長時間ないし反復的なバルーン拡張またはアテローム切除術中に心筋虚血の状態となっている間の冠動脈かん流を維持し、血行動態を支える上で、Impella補助を使用することの合理性を示しています。医療従事者はImpella補助により、完全な血行再建と、実現し得る最高の転帰を患者さんに提供することができます。」
ImpellaによるProtected PCIがLVEFおよび心不全症状の改善をもたらすことを示すエビデンスが数多く示されていますが、Restore EFはその一つとなります。こうした研究には下記が含まれます。
- Burzottaらは、ImpellaによるProtected PCIが、90日時点で複雑な高リスク患者におけるLVEFの改善をもたらすことを明らかにした(27%対33%、p<0.001)。また著者らは、より完全な血行再建がLVEFと生存率の改善につながることも発見。
- PROTECT IIランダム化対照試験は、ImpellaによるProtected PCIが、90日時点でNYHA分類のIII度およびIV度の心不全症状に58%の改善をもたらすことを示した(p<0.001)。本試験はまた、ImpellaによるProtected PCI後のフォローアップ中に、患者のLVEFが22%改善することも明らかにした(p<0.001)。
- Mainiらは、ImpellaによるProtected PCI後のフォローアップでLVEFが17%改善することを示した(p<0.0001)。
Restore EFから得られた知見は、近く予定されているPROTECT IVランダム化対照試験の試験プロトコルに必要な情報を得るために使用されます。PROTECT IVは前向きの2群試験として、Impellaを使用した完全血行再建PCIと、血行動態補助が一切計画されていない完全血行再建PCIを比較します。PROTECT IVは、Impellaが高リスクPCI向けの臨床ガイドラインでClass Iの推奨を獲得するためのクリニカルエビデンスの一部となります。
Restore EF試験は、アビオメッドがスポンサーとなった研究であり、患者転帰を改善する臨床研究に投資するという当社のコミットメントを反映するものです。
高リスクPCIにおけるベストプラクティスを共有するために、アビオメッドはTCTコネクトにて、10月17日(土曜)の東部夏時間午後2時00分に、「COVID-19の時代におけるProtected PCI:完全血行再建の重要性が高まる」と題するシンポジウムを開催します。シンポジウムの司会を務めるのは、アトランタのノースサイドホスピタル心臓血管研究所の最高科学責任者(CSO)で米国心臓血管造影検査インターベンション学会(SCAI)会長のCindy Grines医師(MD)です。本シンポジウムでは、高リスク患者で経皮的・機械的循環補助を使用して完全血行再建を達成するためのベストプラクティスを取り上げます。
IMPELLA心臓ポンプについて
Impella 2.5®およびImpella CP®の各デバイスは、閉塞した冠動脈を再開通するためにステント留置術またはバルーン血管形成術などの待機的または緊急の経皮的冠動脈形成術(PCI)を受ける特定の進行性心不全患者の治療を目的として、米国食品医薬品局(FDA)より市販前承認(PMA)を取得している心内留置型ポンプです。Impella 2.5、Impella CP、SmartAssist®搭載Impella CP、Impella 5.0®、Impella LD®、SmartAssist®搭載Impella 5.5™は、心原性ショック状態にある急性心不全心筋症患者の治療に使用する心臓ポンプとして米国食品医薬品局(FDA)の承認を取得しており、心臓の自然な回復を可能にする独自の機能を有しているため患者さんが自分の心機能を回復させ帰宅することができます。Impella RP®は、右室不全および左心補助人工心臓の埋込、心筋梗塞、心臓移植、開胸手術後に発生する非代償性心不全の治療を目的として米国食品医薬品局(FDA)の承認を受けています。またImpella RPは、病院環境における医療提供者(HCP)による緊急使用として、体表面積1.5 m2以上の救急患者さんを対象に最長14日間までの一時的な右心室補助の実施、さらには肺塞栓症(PE)を含め、コロナウイルス感染症(COVID-19)と関連した合併症に起因する急性右心不全または代償不全の治療を目的とした使用も認められています。Impella RPはCOVID-19と関連した合併症に起因する急性右心不全または代償不全の治療用として承認されていません。またImpella Left Ventricular(LV、左室)補助装置は、COVID-19に感染していることが確認され、ECMO治療を受け、静脈-動脈(V-A)ECMO補助療法中に肺水腫を発症したか、静脈-静脈(V-V)ECMO補助療法中に心筋炎による遅発性心代償不全を発症した救急患者を治療するために病院環境における医療提供者(HCP)が一時的な(Impella 2.5、Impella CP、SmartAssist搭載Impella CPの場合4日以内、Impella 5.0、SmartAssist搭載Impella 5.5の場合14日以内)左室負荷軽減・補助のための緊急使用も許可されています。使用許可を受けたImpella左室補助装置は、許可された適応症に対し認可ないし承認されたわけではありません。Impella RPおよびImpella LVの補助装置は、上記の緊急使用につきEUAに基づくFDAの許可を受けており、許可が終了するか早期取り消しされない限り、連邦法 21 U.S.C. § 360bbb-3(b)(1)の564(b)(1)条に基づく医療機器の緊急使用許可を正当化する状況が存在するという宣言の期間中に限って許可されています。
欧州でImpella 2.5、Impella CP、SmartAssist搭載Impella CPは、高リスクPCIおよび心原性ショックショックを伴う急性心筋梗塞(AMI)の患者さんの最長5日間の治療を対象としてCEマークを取得しています。Impella 5.0およびImpella LDは、心原性ショックを伴う心臓発作または心筋症の患者さんの最長10日間の治療を対象としてCEマークを取得しています。SmartAssist®搭載Impella 5.5™は、急性心不全または心原性ショックを伴う心筋症の患者さんの最長30日間の治療を対象としてCEマークを取得しています。Impella RPは、右心不全および左心補助人工心臓埋込、心筋梗塞、心臓移植、開胸術後に発生する代償不全に陥った心不全の治療デバイスとしてCEマークを取得しています。
承認された適応症や、デバイスの使用に伴う重要な安全性・リスク情報を含め、Impella心臓ポンププラットフォームの詳細については、https://www.impella.com/をご覧ください
アビオメッドについて
米マサチューセッツ州ダンバースに拠点を置くアビオメッドは、循環補助デバイスのリーディングカンパニーです。当社製品は血行動態を改善し、心臓のポンプ機能を補助することで心筋の負担を軽減し、その回復を目指しています。詳細情報についてはhttps://www.abiomed.com/をご覧ください。Abiomed、Impella、Impella 2.5、Impella 5.0、Impella 5.5、 Impella LD、Impella CP、Impella RP、SmartAssist、Impella Connectは、アビオメッドの登録商標で、米国および一定の外国で登録されています。Impella BTR、Impella 5.5、Impella ECP、CVAD Study、STEMI DTU Studyはアビオメッドが商標登録出願中です。
将来見通しに関する記述
本リリースは、アビオメッドの既存製品および新製品の開発、営業活動による企業としての成長、将来的可能性、および行政当局による承認の見込みに関する記述等の将来の見通しに関する記述が含まれます。当社の実績は多くの要因によりこの将来の見通しに関する記述の中で記載とは大きく異なる可能性があり、それらの要因には、COVID-19の世界的流行病がもたらす影響の範囲・規模・期間、開発、試験、関連行政当局による承認に伴う不確定要素(将来の損失の可能性を含む)、さらには将来的な損失が生じる可能性、複雑な製造工程、高品質に関する要件、限られた供給源への依存、競争、技術的変更、行政規制、訴訟問題、今後の資金需要と追加資金の不確実性に加え、直近に提出したForm 10-Kの年次報告書とその後SECに提出・提供した書類を含め、証券取引委員会に提出した当社の報告書に記載されたその他のリスクおよび課題が含まれます。利用者は、本プレスリリースの発表日時点に述べられている将来の見通しに関するいかなる記述についても過度に依拠することのないようお願いいたします。当社は、本プレスリリースの発行日以降に発生する事象、または予想外の出来事の発生によって、見通しまたは予測など、当社の将来の業績に関する見通しを更新し、または修正する義務を負うものではありません。これらの訂正は、本リリースの日付以降に発生する出来事や状況を反映させたり、予想外の出来事を反映させたりする場合に行われる可能性があります。
本プレスリリースは、米国アビオメッド・インクが現地時間2020年10月14日に発表した英文プレスリリースを日本語訳したものです。正式な言語は英語であり、日本に適応しない内容が含まれます。解釈は英語が優先されます。
本記者発表文の公式バージョンはオリジナル言語版です。翻訳言語版は、読者の便宜を図る目的で提供されたものであり、法的効力を持ちません。翻訳言語版を資料としてご利用になる際には、法的効力を有する唯一のバージョンであるオリジナル言語版と照らし合わせて頂くようお願い致します。
businesswire.comでソースバージョンを見る:https://www.businesswire.com/news/home/20201021006161/ja/
CONTACT
Tom Langford
Director of Communication
(978) 882-8408
TLangford@abiomed.com





