ストレス顆粒の主要因子TIA-1、PLDの変異が神経変性疾患を引き起こす仕組みは?
京都大学は9月13日、筋萎縮性側索硬化症(ALS:Amyotrophic lateral sclerosis)発症に関わる機構として、T-cell intracellularantigen-1(TIA-1)のプリオン様ドメインに生じるアミノ酸変異が高密度な凝縮構造を形成することがその一因となっていることを解明したと発表した。この研究は、同大大学院理学研究科の関山直孝助教、児玉高志同研究員(研究当時、現:大阪大学蛋白質研研究所)、杤尾豪人同教授、理化学研究所放射光科学研究センターの高場圭章基礎科学特別研究員、眞木さおり同研究員、米倉功治グループディレクター(東北大学多元物質科学研究所教授を併任)らの研究グループによるもの。研究成果は、「Proceedings of the National Academy of Sciences of the United States of America」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
相分離とは、水に浮く油のように2つの物質が混ざり合わず2相に分かれる現象のことで、近年、この相分離現象が細胞内でも起こっていることが明らかとなってきた。液-液相分離(LLPS:LiquidLiquid Phase Separation)と呼ばれるこの現象は、タンパク質が液滴の性質を有する凝縮体、いわゆる非膜型オルガネラ(MLOs:Membraneless organelles)を形成する生物学的事象のことだ。LLPSはタンパク質の機能を時空間的に制御するメカニズムであると考えられており、多岐にわたる生理学的機能の理解につながることが期待されている。
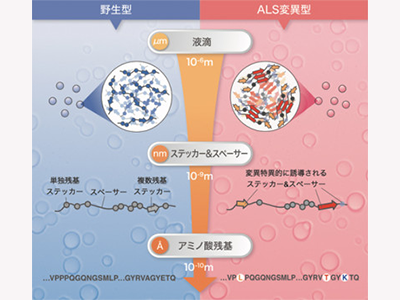
細胞質に形成されるMLOsの一種にストレス顆粒(SGs)がある。SGsの主要な構成因子の一つであるTIA-1は、特定の立体構造を持たない天然変性タンパク質領域であるプリオン様ドメイン(PLD:Prion-like domain)を持つ。TIA-1のPLDは自己凝縮能を持つことから、LLPSを駆動する中心的な役割を担っていると考えられていた。加えて、家族性ALSやウェランダー遠位型ミオパチー(WDM:Welander distal myopathy)の遺伝子解析から、TIA-1のPLDにはこれら神経変性疾患に関わるアミノ酸変異が確認されていた。しかし、これらのアミノ酸変異がどのように病気を引き起こすのか、その分子メカニズムはわかっていない。そこで今回の研究は、TIA-1のPLDの液滴形成能と疾患関連アミノ酸変異の関係を明らかにすることを目的とした。
TIA-1のsmPDL領域、1アミノ酸レベルのALS変異で液滴形成促進
今回の研究では、TIA-1のアミノ酸配列の中で、液滴形成能を持つ最小領域を探索。その結果、温度依存的に凝縮と溶解を繰り返すsmall PLD(smPLD)領域を同定した。smPLD液滴に対して ALS変異が与える影響を生化学的手法により解析したところ、ALS変異であるP362LとA381Tは野生型に比べて液滴形成を促進することがわかった。
研究グループは、これらALS変異の影響をさらに詳しく調べるために、構造学的手法を用いてTIA-1 PLD分子の動的な構造を解析。核磁気共鳴法(NMR:Nuclear magnetic resonance)による解析では、PLDの動的構造は、アミノ酸の物理化学的性質が5残基単位で協調することで決定されていることがわかった。この結果は、1つのアミノ酸変異であっても、アミノ酸配列の並び方によって周囲への影響が異なることを示唆している。
A381T変異による不可逆的なアミロイド線維形成がALS発症に結び付く可能性
次に、分子動力学シミュレーションを用いて、野生型とP362Lの動的構造を比較。その結果、P362Lでは変異箇所周辺にベータヘアピン構造を形成しやすいことがわかった。このような分子内ベータシート相互作用の増強は、P362L変異型がアミロイド線維を形成しやすい性質へ変化したことを示唆している。
A381T変異に関しては、野生型とA381T変異箇所を含む2種類のペプチドの結晶を作成し、3次元電子線回折法を用いてこれらの結晶構造を原子レベルで明らかにした。その結果、野生型およびA381T変異型の両ペプチドは逆平行ベータシート構造を形成することがわかった。しかし、その階層構造には大きな違いがあり、野生型では三角形のハニカム構造を形成していたのに対し、A381T変異型ではベータシートが層状に積み重なった積層構造を形成していた。A381T変異型が作る高密度な凝縮構造は、液滴から不可逆的なアミロイド線維が形成される要因になることを示唆している。研究グループは、このような構造変化が病気の発症につながるのではないかと考えているとしている。
TIA-1の凝縮構造、ALS治療薬開発への貢献に期待
TIA-1は、SGsの主要な構成要素であるだけでなく多様な生理学的機能を持つことから、SGsの発見以来、約20年に渡って研究されてきた。今回の研究では、疾患関連アミノ酸変異がTIA-1の液滴形成能をどのように変えるかを原子レベルで解明し、TIA-1 PLD液滴内で働く分子間相互作用の特性を定量化した5アミノ酸モデルを提案。このモデルは、アミノ酸変異が凝縮体の特性に及ぼす影響を定量的に評価することができるため、天然変性タンパク質領域に生じる疾患関連アミノ酸変異と病気の発症メカニズムの関連を解明する可能性を秘めているという。また、同研究成果は、TIA-1が形成する凝縮構造を標的としたALS治療薬の開発などに貢献することが期待される、と研究グループは述べている。
▼関連リンク
・京都大学 最新の研究成果を知る








