SBMAはアンドロゲン受容体のCAGリピート延長によるポリグルタミン病
名古屋大学は7月13日、運動ニューロンで特異的に発現するMID1が、異常なアンドゲン受容体の産生を増加させることによって軸索障害を生じうることを明らかにしたと発表した。この研究は、同大大学院医学系研究科神経内科学の勝野雅央教授、佐橋健太郎講師、飯田円助教、蛭薙智紀医員、小椋陽介医学部生(筆頭研究者)らの研究グループが、同研究科細胞生物学の宮田卓樹教授との共同研究として行ったもの。研究成果は、「Cell Death & Disease」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
球脊髄性筋萎縮症(SBMA)は、発語や嚥下の際に使用される筋や舌、四肢、体幹の筋の萎縮に伴い、進行性の運動障害をきたす疾患。SBMAは、脳幹や脊髄の運動ニューロンが障害を受けて、細胞死を起こして失われる運動ニューロン疾患に含まれる遺伝性の指定難病だ。患者数は世界的に10万人あたり2人程度で、日本国内では2,000人程度のSBMA患者が推定されている。日本では治療薬としてリュープロレリン酢酸塩が承認されているが、その効果は十分ではない。
SBMAはアンドロゲン受容体遺伝子の第1エクソンに存在するCAGリピートの異常延長を原因とし、通常成人男性に発症する。CAGリピートはアミノ酸の一種であるグルタミンの繰り返し配列であるポリグルタミンに翻訳される。このため、SBMAの患者体内では異常に延長したポリグルタミンをもつアンドロゲン受容体タンパク質が産生され、アンドロゲンの存在下で細胞の核内で不溶性の凝集体を形成することで、運動ニューロンを細胞死に至らせると考えられている。
メカニズム解明のためモデルマウス作製、運動ニューロン特異的に発現のMID1に注目
勝野教授らは、以前の研究において、異常延長したCAGリピートをもつヒトアンドロゲン受容体の遺伝子組み換えマウス(SBMAモデルマウス)を作製した。SBMAモデルマウスのオスでは、アンドロゲン依存的な運動障害が再現されている。アンドロゲン受容体タンパク質の発現は運動ニューロンに限らずさまざまな細胞で見られるが、SBMAにおいて特に運動ニューロンに障害が生じやすいメカニズムは十分に理解されていなかった。今回、研究グループは、SBMAモデルマウスを利用し、運動ニューロン脆弱性のメカニズムを明らかにすることを目指して研究を開始した。
研究グループはまず、SBMAモデルマウスの脊髄で発現異常を示す遺伝子の中から、運動ニューロンで特異的な発現を示す遺伝子を探索し、運動障害の発症早期から発現上昇を示すMID1に注目した。MID1は、マウスおよびヒトの脊髄において、運動ニューロンで特異的に発現していることが免疫組織化学染色によって確認された。
MID1がアンドロゲン存在下で異常な受容体を増加させ、軸索伸長障害が悪化
MID1はアンドロゲン受容体遺伝子などのCAGリピートをもつ遺伝子のmRNA群に結合し、それらがタンパク質へ翻訳される反応を促進することが知られている。研究グループが運動ニューロンのモデル培養細胞を用いた実験においても、MID1は異常なアンドロゲン受容体のタンパク質レベルをアンドロゲンの存在下で著明に増加させた。一方、同様なタンパク質レベルの増加はCAGのリピート数が正常なアンドロゲン受容体では認められなかった。
ヒトおよびマウスではMID1の発現は胎児期から既に始まっていることが知られており、今回の研究で行ったマウスでの解析から、運動ニューロンでのMID1発現も胎児期から見られることが明らかとなった。そこで研究グループは、SBMAにおける運動ニューロン障害へのMID1の関与を評価するために、マウス胎児の脊髄を培養する実験を考案し、軸索の伸長への影響を調べた。SBMAモデルマウスに由来する脊髄のスライス切片を培養すると、アンドロゲンを添加しない条件下では運動ニューロンから伸長した軸索が多数観察されたが、アンドロゲンを添加すると軸索の伸長がほとんど観察されなかった。
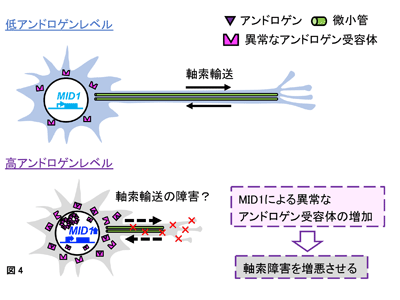
また、メス由来の脊髄の培養では、オス由来の脊髄と比較してアンドロゲン添加による軸索伸長の抑制の程度が弱いことが確認された。そこでメス由来の脊髄をアンドロゲン添加下で培養し、MID1を過剰発現させるレンチウイルスを添加したところ、異常なアンドロゲン受容体タンパク質が増加するとともに軸索伸長がさらに抑制された。一方、オス由来の脊髄をアンドロゲン添加下で培養し、MID1の発現を抑えるshRNAを発現させるレンチウイルスを添加したところ、異常なアンドロゲン受容体タンパク質が減少して軸索伸長が回復された。これらの結果から、MID1はアンドロゲン存在下において、アンドロゲン受容体を増やすことでSBMAにおける運動ニューロンの軸索伸長障害を悪化させていることが明らかになった。
MID1を標的とした治療薬開発に期待
今回の研究により、運動ニューロンに本来発現するタンパク質であるMID1の発現上昇が、SBMAで見られる運動ニューロンの脆弱性に関与することが示された。また、そのメカニズムとして、MID1が異常なアンドロゲン受容体タンパク質を増加させることにより生じる軸索障害が重要と考えられた。SBMAモデルマウスを用いた先行研究からは、異常なアンドロゲン受容体による軸索輸送の障害が示唆されている。MID1は軸索に存在する微小管への結合能も有しているため、異常なアンドロゲン受容体により軸索の形成や維持に重要な軸索輸送が障害されている可能性がある。今後の展開として、MID1が異常なアンドロゲン受容体に依存して軸索障害をもたらすメカニズムを解明し、MID1やMID1と相互作用するタンパク質を標的とした治療薬の開発につなげていきたいとの考えを、研究グループは示している。








