SbmA、近縁種細菌の細胞内に抗菌ペプチド分子が入っていく際に重要な働き
京都大学は9月9日、細菌の膜輸送体タンパク質「SbmA」の精密な立体構造を解明したと発表した。この研究は、同大大学院医学研究科の岩田想教授、野村紀通准教授、千葉大学グローバルプロミネント研究基幹(元:京都大学医学研究科研究員)の小笠原諭特任准教授と、英国・インペリアルカレッジロンドンのKonstantinos Beisグループリーダー、同日本学術振興会海外特別研究員(高輝度光科学研究センター研究員兼任)稲葉理美氏、ポーランド・ヤギェウォ大学のJonathan Heddle教授らとの共同研究によるもの。研究成果は、「Science Advances」にオンライン掲載されている。
画像はリリースより
自然界における細菌群集の中では、栄養分をめぐって互いに生存競争が繰り広げられている。この競争を有利に進めるために、ある種の細菌は競争相手である近縁種細菌の増殖を抑える作用のある抗菌ペプチドを「飛び道具」として分泌する。多くの場合、「飛び道具」の作用標的は競争相手の細菌の増殖を維持するのに重要な細胞内タンパク質(酵素など)であるため、これらが攻撃効果を発揮するためには近縁細菌の細胞膜を介して細胞内に取り込まれる必要がある。
抗菌ペプチドは多種多様な分子の大きさや化学構造をもった化合物群であるが、これらが近縁細菌の細胞内に取り込まれる際には、膜輸送体タンパク質(トランスポーター)SbmAの働きが重要であることがわかっている。しかし、どのようなメカニズムによってSbmAが多種多様な抗菌ペプチドを細胞内に輸送するのかという疑問に対し、SbmAの精密な立体構造を解明し、その情報に基づいてメカニズムを分子レベルで検証する必要があった。
抗体フラグメントを用いてクライオ電子顕微鏡単粒子解析法により立体構造を決定
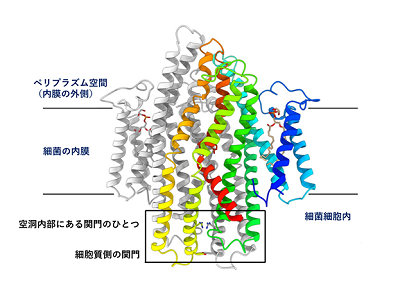
タンパク質など生体高分子の立体構造を研究する手法として、近年、「クライオ電子顕微鏡単粒子解析法」(以下、クライオ電顕法)が目覚ましい発展を遂げている。膜タンパク質の立体構造をクライオ電顕法で解明する際には、電子顕微鏡画像データの解析が技術的に難しい面があった。しかし今回研究グループは、抗体フラグメントを膜タンパク質に結合させた複合体粒子の画像を撮影し、抗体が結合している部分を目印にして位置合わせを行うという画像解析処理の工夫を行い、3.2 Å分解能でのSbmAの精密立体構造を決定した。
SbmAは同じサブユニットが2つ会合して働くホモ二量体であるが、立体構造をみると2つのサブユニットが組み合わさった内側に大きな空洞が形成されており、これが抗菌ペプチドを細胞内へと誘う輸送経路であることがわかった。空洞の体積は、さまざまな化学構造をもった抗菌ペプチドを収容するのに十分なだけの大きさがあることもわかった。また、立体構造は、この空洞は細胞膜の外側に向かって大きく口を開いた状態であり、細胞外側から抗菌ペプチドがこの空洞に進入してくるのを待ち受けている状態だと考えられた。空洞の内部には、抗菌ペプチドの輸送経路で幅が狭くなっている部分が2か所あり、化合物の構造を選別して通過させる「関門」ではないかと考えられた。また細胞質側の端部分にもさらに1つ「関門」があり、それは閉じている状態だった。
SbmAが抗菌ペプチドを細胞内に取り込む分子メカニズムも解明
このような立体構造上の特徴から、SbmAは細胞膜(正確にはグラム陰性細菌の内膜)の両側に形成されるプロトン濃度勾配をエネルギー源として使って構造変化を起こし、抗菌ペプチドを細菌細胞内へ取り込ませるタイプの膜輸送体(トランスポーター)であることが明らかになった。さらに、内部空洞の表面に分布しているアミノ酸残基(グルタミン酸が「はしご状」に位置しているGlu ladder等)がどのような役割をしているかを、生化学実験により検証し、SbmAが抗菌ペプチドを細胞内に取り込む分子メカニズムを解明した。
これまで数多くの膜輸送体の立体構造がすでに解明されてきたが、SbmAの立体構造の特徴は非常にユニークであり、既存の膜輸送体の構造分類のどれにもぴったりとは当てはまらなかったため、「SbmA-like peptide transporters(SLiPT)」と名づけた新しい構造分類を提唱した。
研究グループは、「抗菌ペプチドがその作用を発揮するためには、細菌細胞膜にあるSbmAという関門をまず通過することが必須だ。今回明らかになった立体構造情報と計算科学(シミュレーション)を組み合わせることにより、SbmAを通過することができる物質にはどのような化学構造上の制約があるのかという点についての理解が進み、より良い抗生物質の開発につながることを願っている」と、述べている。
▼関連リンク
・京都大学 最新の研究成果を知る








