DNAの破壊力が強く飛距離が短いアルファ線を小線源治療に応用できるか?
大阪大学は8月25日、アルファ線を放出する核種アスタチン211( 211 At)をがんの病巣に直接投与して治療を行う薬剤を開発したと発表した。この研究は、同大大学院医学系研究科放射線統合医学講座核医学の加藤弘樹准教授、同理学研究科天然物有機化学研究室および大阪大学放射線科学基盤機構の共同研究グループによるもの。研究成果は、「Journal of Nanobiotechnology」に掲載されている。
画像はリリースより
がんの治療のひとつとして、ガンマ線あるいはX線の外照射に加えて、前立腺がん、乳がん、舌がん、子宮がん、頭頸部がん、そして最近海外では、脳腫瘍などに対して密封X線源を用いた小線源治療が行われている。X線あるいはガンマ線を体外から照射する外照射治療は、病巣より広い範囲に影響が及ぶため、正常組織の被ばくによる副作用が避けられない。一方、小線源治療はRIが密封されていて拡散しないため、正常組織への影響は外照射や標的核医学治療に比して少ないものの、X線の近接臓器への漏洩による副作用は無視できない。ベータ線、アルファ線核種は生体組織に与える影響が高く、DNAの2本鎖を断裂するため、特に増殖細胞に対して高い障害性がある。一方、アルファ線は飛程が大変短いため、線源を適切に分布させれば、正常組織の被ばくはほとんどない。この性質によって、X線あるいはガンマ線照射による前記副作用は大幅に低減される。アルファ線放出核種で標識した微小サイズのseedを局所分散することによって、強力ながんの局所治療が可能になると考えられる。
アスタチン211+金ナノ粒子、腫瘍に直接注入の実験で増殖を強力に抑制
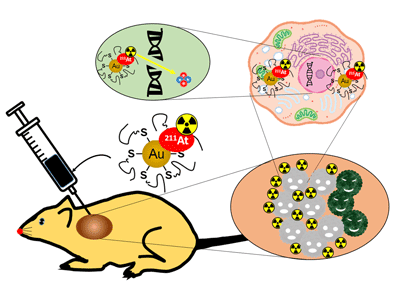
今回、研究グループは、短い半減期で高エネルギーのアルファ線を放出することができるアスタチン211( 211 At)を、体にほぼ無害な金ナノ粒子(AuNP)に結合し、それを局所投与によって腫瘍内に限局的に拡散させる 211 At diffusible nanoseed brachytherapyを開発。その効果を検証した。
この治療法は、安定性、組織親和性を高めるためにAuNP表面をメトキシポリエチレングリコール(mPEG)で修飾した 211 At標識金ナノ粒子( 211 At-AuNP-S-mPEG)を、がんの腫瘤に直接注入し、がん組織の増殖を抑制する全く新しい治療法。培養したグリオーマ細胞に、AuNP-S-mPEGを投与したところ、ナノ粒子が細胞内に取り込まれ内在化することがわかった。そこで、ラットの皮下に移植したがん(グリオーマ)の腫瘍内に、 211 At-AuNP-S-mPEGを超音波ガイド下で投与したところ、腫瘍内には拡散するものの、腫瘍外の正常臓器にはほとんど集積しないと判明。 211 At-AuNP-S-mPEGを局所投与した腫瘍は、生理食塩水を投与した腫瘍と比べて増殖が非常に強く抑制されることが確認された。また、 211 At-AuNP-S-mPEGを投与した動物には体重変化がなかった。さらに、 211 At-AuNP-S-mPEGをマウスの皮下に移植したヒトの膵がんに局所投与したところ、薬剤はグリオーマ同様、膵がんの腫瘍のみに集積し、同様に非常に強い腫瘍増殖抑制効果を示した。
以上より、今回の研究で開発したアスタチン標識金ナノ粒子は、非常にシンプルな構造ながら、がんの種類によらない効果をもつ、強力で安全な局所治療であることが確認された。
多くのがんに応用可能、今後臨床応用の検討へ
近年、アルファ線放出核種で標識した、悪性腫瘍標的薬剤が注目され、開発研究が盛んに行われている。ほとんどすべてが、静脈を介して全身に分布させる薬剤であり、転移病変の治療も併せて行うことができる一方、標的外の集積は正常組織の被ばくにつながる。全身を対象とした治療に対して、光免疫療法のような低侵襲で局所的な治療も大変期待されている。研究グループの提案するこの治療法は全く新しいがんの局所治療であり、強力な放射線治療を低侵襲で副作用なく行うことができる。また、金ナノ粒子は放射線治療の効果を増大させる増感剤でもある。従って、この治療と放射線外照射治療を組み合わせることで、さらなる治療効果が期待できる。また、この治療は血流の少ない腫瘍、薬剤の届きにくい病変にも有効であり、従来の化学療法と併せて行うことで相補的な効果が期待できる。さらに、この薬剤は非常にシンプルな構造で効果を発揮するが、金ナノ粒子はさらに他の化合物を追加的に搭載できる余地があるので、今後の研究によってさらなる用途の拡大が見込まれる。
このように、今回の研究で治療法は汎用性と発展性という点において、今後のがん治療に影響を与える新しい治療コンセプトだといえる。研究グループは今後、同治療法の臨床応用を検討する予定だとしている。この薬剤は、口腔がん、皮膚がん、乳がん、消化器がん、そして脳腫瘍等、多くのがんに応用可能であり、現在、舌がんへの応用に向けた検討を進めているという。また、「がんの腹膜播種や、がん摘出腔に対する再発予防のための薬剤散布治療への応用や、リンパ組織への投与によるリンパ節転移の治療への応用検討、さらには、抗体を搭載してがん特異性と治療効果をさらに高めた製剤の開発などを開始している」と、研究グループは述べている。
▼関連リンク
・大阪大学 ResOU








