発がん性の強いクロシドライトと発がん性の低いアンソフィライトの影響を比較
名古屋大学は7月2日、アスベスト繊維による悪性中皮腫発がんメカニズムの一端を明らかにしたと発表した。この研究は、同大大学院医学系研究科生体反応病理学の伊藤文哉研究員と豊國伸哉教授らの研究グループによるもの。研究成果は、科学誌「Redox Biology」の電子版に掲載されている。
画像はリリースより
アスベストは、いまだに世界中で使用されており、悪性中皮腫を発生する発がん物質として広く問題視されている。これまで、アスベスト繊維の発がん機構の研究は、アスベスト繊維が中皮細胞に取り込まれ核内へも直接作用することで発がんが起こるという見方と、アスベストが引き起こす炎症を介して間接的に中皮細胞をがん化させるという見方の2つの観点から進められてきた。この議論については、未だ決着がついていない。
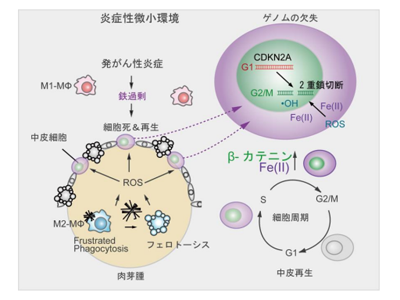
アスベストは鉄との関連が強く、研究グループは先行研究により、鉄を含むタンパク質のアスベストによる吸着、瀉血による除鉄でラット悪性中皮腫発症を遅延できることなどを報告してきた。しかし、悪性中皮腫の70%以上においてがん抑制遺伝子p16INK4aの欠失を認めるにも関わらず、なぜアスベスト繊維曝露がこの遺伝子領域の欠失にいたるのか、という疑問は解決されていない。
そこで、今回の研究では、鉄代謝異常という環境変化を伴うアスベスト発がん機構を解明するため、発がん性の強いクロシドライト(青石綿)と発がん性の低いアンソフィライト(直閃石)の影響を比較し、培養細胞および実験動物を使用した実験を実施した。
アスベスト<中皮細胞死<βカテニン高発現<DNA二本鎖切断
研究では、アスベスト繊維の生体内における局在を確認するために、ラット腹腔内にクロシドライトおよびアンソフィライトを投与。その結果、投与後数日はアスベスト繊維が中皮細胞に接触していたものの、投与後2週間以降には生体防御反応により炎症細胞や線維芽細胞が直接アスベストに接し(肉芽腫)、多くは肉芽腫内のマクロファージに貪食されていることが判明した。
また、中皮細胞は、肉芽腫の表面の一部を覆い、アスベスト繊維とは離れて存在していた。とくに、クロシドライト投与後の間質では、貪食細胞マクロファージの継続的細胞死を伴いながら鉄過剰状態となり、中皮細胞が常に鉄に曝露される環境にあることを見出した。
一方、中皮細胞がアスベスト繊維曝露による細胞死後、残存中皮細胞の再生にβ-カテニンを高発現することを見出し、β-カテニン高発現の中皮細胞集団で多くDNAの2本鎖切断が発生することが明らかとなった。
最後に、アスベスト繊維を直接作用させた中皮細胞と比較した結果、H2O2による酸化ストレスを負荷した中皮細胞では、がん抑制遺伝子であるp16タンパク質、および遺伝子の位置がその近傍にあるp15のタンパク質発現が低下していた。
中皮細胞再生時におけるβ-カテニンの高発現は、p16INK4a欠失に複数のメカニズムを介して寄与
今回の研究成果により、触媒性Fe(II)依存的な中皮腫発がん機構の一端が解明された。また、中皮細胞再生時におけるβ-カテニンの高発現はp16INK4aがん抑制遺伝子欠失に複数のメカニズムを介して寄与することが明らかとなった。
研究グループは、すでにアスベストに曝露された患者の悪性中皮腫発症を予防する戦略の基盤となる知見が得られたとし、すでに報告されている除鉄や抗炎症などに加え、β-カテニン経路も悪性中皮腫予防のための分子標的として期待される、と述べている。
▼関連リンク
・名古屋大学 プレスリリース








