不明だった「生存細胞」と「自殺細胞」の制御
基礎生物学研究所は9月5日、ストレス応答MAPキナーゼ(SAPK)「p38」とリン酸化酵素「JNK」の活性を生きた細胞内で観察できる蛍光レポーターを開発し、p38とJNKの活性を観察したところ、JNKはp38によって負に制御されることや、負の制御が細胞間でばらつくために、JNK活性が細胞間でばらつくことを見出したと発表した。
画像はリリースより
この研究は、基礎生物学研究所定量生物学研究部門/生命創成探究センター定量生物学研究グループの三浦晴子研究員、近藤洋平助教、青木一洋教授らと、京都大学の松田道行教授との共同研究によるもの。研究成果は、米学術誌「Cell Reports」オンライン版で公開された。
多細胞生物を構成する細胞は、ストレスにより回復不能なまでダメージを受けた場合、積極的にアポトーシスと呼ばれる細胞死を誘導し、自殺することが知られており、ある割合の細胞がアポトーシスすることで、組織全体や個体としてのストレスに対して適応すると考えられている。また、悪性腫瘍の治療で使われる放射線治療や多くの抗がん剤は、DNAを傷つけて腫瘍細胞をアポトーシスに導くが、すべての腫瘍細胞を殺すことは難しく、これが治療抵抗性の一因となっている。
アポトーシスを活性化させる際に重要となるのが、p38とJNKだ。p38とJNKがどのようにして、アポトーシスのスイッチを入れるのか、また生存細胞と自殺細胞をどのようにして制御しているのかについては、不明だった。
JNK活性が高い細胞でのみアポトーシスが発生
研究グループは、感度のよいp38活性の蛍光レポーターを独自に開発し、既存のJNKレポーターと組み合わせたシステムを構築。これにより、1細胞レベルでp38とJNKの活性を同時に可視化することに成功したという。
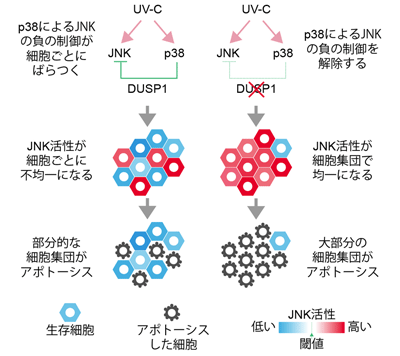
次にさまざまなストレスに細胞をさらした際のp38とJNKの活性を定量化したところ、p38がJNKを負に制御する分子機構が明らかになった。この負の制御機構は、翻訳後修飾によるものと転写を介するものの2種類に分けられ、後者の分子機構はDUSP1というJNKの不活性化因子の発現誘導であることを見出したという。さらに、JNKの活性は細胞間でばらつくこと、このJNK活性の細胞間の不均一性は、p38からJNKへの負の制御を阻害剤などで抑制すると消失することが判明した。
最後に、JNK活性の細胞間の不均一性の意義を検証するために、紫外線によるp38とJNKの活性分布とアポトーシスの関係を調査。その結果、紫外線刺激によってJNK活性がばらつくことや、JNK活性が高い細胞でのみ、アポトーシスが起きることが明らかになった。また、このばらつきはDUSP1をノックアウトすることで消失し、ほとんどの細胞がアポトーシスすることが判明。さらに、CRISPR/Cas9遺伝子編集法で内在性のDUSP1を可視化したところ、紫外線によるDUSP1タンパク質の発現上昇もばらつきがあり、これにより細胞死の運命を決定していることが明らかになったとしている。
今回、明らかになったp38によるJNK活性とアポトーシスの抑制は、抗がん剤や放射線治療後の腫瘍細胞の部分的な殺傷と治療抵抗性に寄与している可能性があるという。研究グループの青木教授は「このようなシグナル伝達の不均一性を制御することで、放射線治療や抗がん剤の効果を増加させるような取り組みに発展させることが出来るかもしれない」と述べている。
▼関連リンク
・基礎生物学研究所 プレスリリース








