米マサチューセッツ州ダンバース

アビオメッド(NASDAQ: ABMD)は、小口径血管アクセスを介したImpella心臓ポンプ挿入を実現するための開発で2件のマイルストーンを達成したと発表しました。Impella ECP心臓ポンプは米国食品医薬品局(FDA)アーリーフィージビリティスタディ(EFS)の第1段階を完了しており、Impella XRシースに対する510(k)承認をFDAより取得しました。
本プレスリリースではマルチメディアを使用しています。リリースの全文はこちらをご覧ください。:https://www.businesswire.com/news/home/20201217006231/ja/
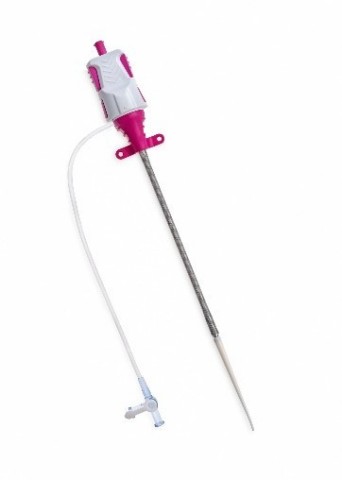
Impella XRシースの挿入時のサイズは10 Frで、Impella留置中に瞬間的に拡張してからリコイルする。(写真:ビジネスワイヤ)
Impella XRシースは、拡張・リコイルするロープロファイルのシースで、小口径血管アクセスを介してImpella 2.5心臓ポンプ挿入を実現します。本シースの挿入時のサイズは10フレンチ(Fr)で、柔軟性を備えたニチノールブレードはImpella留置中に瞬間的に拡張してからリコイルし、複雑なインターベンションのためのアクセスを簡素化します。Impella XRシースは、大口径シースと比較して動脈アクセス部位の外傷を減少することを目的としています。
Impella XR シースは、米国外の患者で複数回にわたり研究されています。米国初となる患者の治療は2021会計年度第4四半期での開始が見込まれます。
さらにアビオメッドは、5例の組み入れ患者に対してImpella ECPによるEFSの第1段階を成功裏に完了しました。Impella ECPは世界最小の心臓ポンプです。挿入時及び体外抜去時の直径は9 Frです。体内に留置された後は拡張して心臓のポンプ機能を支え、3.5 L/分以上のピーク流量を提供します。
この前向き多施設非無作為化EFSは、アビオメッド、治験担当医師、FDAが、高リスクの経皮的冠動脈インターベンション(PCI)患者での本装置の使用につき、安全性と実現可能性の定性的評価を実施できるようにデザインされています。アビオメッドはこの第一段階EFS試験データをFDAに提出し、組み入れ患者数を拡大した第2段階の試験に移行するよう要請します。
アビオメッドの最高医療責任者(CMO)であるチャック・サイモントン医師は、次のように述べています。「これらのマイルストーンは、より小型かつ高性能で革新的な製品ポートフォリオを継続的に構築するというアビオメッドのビジョン実現に向けた重要な一歩です。Impella ECPやImpella XRシースのような革新的デザインは、より小口径な血管アクセスを介したImpellaポンプ使用を実現し、患者さんの治療と転帰の改善を促進し続けることになるでしょう。」
Impella ECPは治験での使用に限定されており、臨床試験以外での使用は承認されていません。
アビオメッドについて
米マサチューセッツ州ダンバースに拠点を置くアビオメッドは、循環補助デバイスのリーディングカンパニーです。当社製品は血行動態を改善し、心臓のポンプ機能を補助することで心筋の負担を軽減し、その回復を目指しています。詳細情報についてはwww.abiomed.comをご覧ください。
IMPELLA XRシースについて
Impella XRシースのセットは、Impella 2.5カテーテルおよび付属デバイスの経皮的導入での使用向けです。
IMPELLA ECPについて
注意:Impella ECPは治験用デバイスであり、連邦法により用途は治験での使用に限定されています。
IMPELLA心臓ポンプについて
Impella 2.5®およびImpella CP®の各デバイスは、閉塞した冠動脈を再開通するためにステント留置術またはバルーン血管形成術などの待機的または緊急の経皮的冠動脈形成術(PCI)を受ける特定の進行性心不全患者の治療を目的として、米国食品医薬品局(FDA)より市販を取得している心内留置型ポンプです。
Impella 2.5、Impella CP、SmartAssist®搭載Impella CP、Impella 5.0®、Impella LD®、SmartAssist®搭載Impella 5.5™は、心原性ショック状態にある急性心不全心筋症患者の治療に使用する心臓ポンプとして米国食品医薬品局(FDA)の承認を取得しており、心臓の自然な回復を可能にする独自の機能を有しているため患者さんが自分の心機能を回復させ帰宅することができます。
将来見通しに関する記述
本プレスリリースには将来見通しに関する記述が含まれます。将来見通しに関する記述は、アビオメッドが米国証券取引委員会に提出した定期報告書に記載されたものなど、リスクや不確実性に影響されます。実際の結果は予想された結果とは大きく異なる可能性があります。
本プレスリリースは、米国アビオメッド・インクが現地時間2020年12月15日に発表した英文プレスリリースを日本語訳したものです。正式な言語は英語であり、日本に適応しない内容が含まれます。解釈は英語が優先されます。
本記者発表文の公式バージョンはオリジナル言語版です。翻訳言語版は、読者の便宜を図る目的で提供されたものであり、法的効力を持ちません。翻訳言語版を資料としてご利用になる際には、法的効力を有する唯一のバージョンであるオリジナル言語版と照らし合わせて頂くようお願い致します。
businesswire.comでソースバージョンを見る:https://www.businesswire.com/news/home/20201217006231/ja/
CONTACT
Sarah Karr
Communications Manager
skarr@abiomed.com
(978) 882-8211
Todd Trapp
Vice President and Chief Financial Officer
ttrapp@abiomed.com
(978) 646-1680





