副腎GCと上頚神経節NEによる影響とその分子制御機構を細胞とマウスで検証
愛知医科大学は4月11日、交感神経ノルアドレナリン(ノルエピネフリン:NE)が、食作用を時刻依存的に抑制することで眼圧リズムを制御する仕組みを、ヒトの細胞とマウスを用いた実験で世界に先駆けて明らかにしたと発表した。この研究は、同大医学部生理学講座の池上啓介講師と増渕悟教授の研究グループによるもの。研究成果は、「Communications Biology」にオンライン公開されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
緑内障は、日本における中途失明原因第1位の疾患で、有病率は40歳以上で5%と言われている。緑内障発症の最大のリスク因子の1つとして「眼圧」があるが、眼圧が上昇することにより、視神経が傷害されやすくなると考えられている。すでに複数の眼圧を下げる点眼薬が用いられているが、根治が難しく新たな治療法の開発が喫緊の課題になっている。
生物の多くの生理現象は約24時間周期の概日リズムを持っている。眼圧にも約24時間の概日リズムがあり、眼圧は昼行性夜行性動物ともに夜に上昇する。そのリズムは、毛様体における「眼房水」の産生流入と、線維柱帯・シュレム管からの流出のバランスによって決まり、SCNが制御していると考えられている。多くの末梢組織の概日時計は、SCNからのシグナルを受け取った副腎から分泌される副腎GCまたは交感神経NEによってリセットされるが、研究グループは、眼圧リズムが副腎GCと上頚神経節NEの両因子により形成されることを明らかにしていた。しかし、その詳しい分子制御機構は不明だった。
さまざまな緑内障治療薬のうち、眼房水排出責任部位である線維柱帯をターゲットにしたものは少なく、メカニズムもはっきりしていない。また、眼圧制御では線維柱帯における眼房水排出抵抗の制御が鍵になり、細胞骨格再構成や線維化および眼房水中のごみの食作用などの制御機構が関与していることが知られていた。しかし、これらの機構や眼房水排出の日内変動は不明だった。そこで、研究グループは今回、どの機構が眼圧リズムに関与するかを検証し、時間シグナルであるGCとNEによる影響およびその分子制御機構を細胞とマウスを用いて検証した。
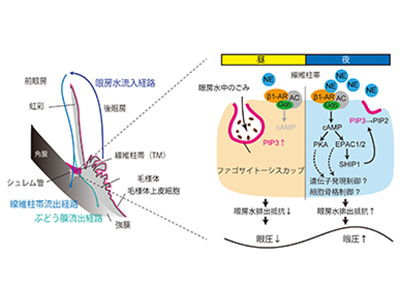
眼房水排出能は明期で高く、眼圧の昼間の低下に関与
まず、薬理学的にマウスの眼房水産生を抑制したが、眼圧リズムは完全に消失しなかった。このことから、眼房水排出も眼圧リズム形成に関与していることが示唆された。次に、ビーズのマウス眼球内投与により排出能を抑制することで、眼房水排出の概日リズム形成における関与を検証した。昼と夜で眼圧を測定したところ、昼の眼圧のみが上昇していた。蛍光粒子の眼球内投与により眼房水排出能の日内変動も確認したところ、明期で亢進していた。これらの結果から、眼房水排出能は明期で高く、眼圧の昼間の低下に関与していることが判明した。
眼圧の昼間の低下に、食作用能の亢進による眼房水排出抵抗の低下が寄与
さらに、眼房水排出抵抗に関わる線維柱帯の細胞骨格の再構成と食作用が、昼間の眼圧低下に寄与しているか検証した。食作用阻害剤や食作用促進剤、アクチン重合阻害剤などをマウスに点眼し、昼夜における眼圧変動への影響を解析したところ、アクチン重合阻害は時刻依存性なく眼圧を低下させ、食作用阻害剤は昼間のみ眼圧を上昇させることが判明。眼圧の昼間の低下に、食作用能の亢進による眼房水排出抵抗の低下が寄与していることがわかった。
β1-AR-EPAC-SHIP1経路によりPIP3が減少し、食作用能が低下
そこで、GCとNEによる線維柱帯食作用へ経時的な影響を、pH感受性粒子を用いて不死化ヒト初代培養線維柱帯細胞で検証。食作用で取り込まれた粒子の蛍光シグナルをリアルタイムモニタリング解析したところ、食作用に概日リズムは見られなかったが、NEのみ一過的に食作用を抑制することを明らかにした。また、薬理学的手法およびRNA干渉を用いた逆遺伝学的手法により、食作用抑制を示すアドレナリン受容体(AR)の種類を同定したところ、主にβ1-ARが重要であることが判明した。β1-ARは、Gs結合型のGタンパク質共役受容体であるため、同様の手法でシグナル伝達経路を解析したところ、cAMP-PKAおよびEPAC経路が活性化されることを発見した。
ホスファチジルイノシトール三リン酸(PIP3)はAKTやERK1/2のリン酸化を介して食作用を促すトリガーであり、実際、不死化ヒト初代培養線維柱帯細胞でもPIP3阻害剤で食作用が抑制された。また、SHIP1やPTEN酵素はPIP3を分解し、減少させる。そこで、cAMP-PKAおよび-EPAC経路が、線維柱帯細胞中のPIP3濃度や分解酵素に与える影響を解析したところ、EPAC経路が分解酵素SHIP1をリン酸化してPIP3を低下させることが示唆された。さらにβ1-AR誘導性の食作用抑制がSHIP1阻害剤で濃度依存的に回復した。NEが免疫細胞の食作用を抑制することは減少として知られていたが、その仕組みは長年不明だった。しかし今回の研究で、β1-AR-EPAC-SHIP1経路によりPIP3が減少し、食作用能が低下する仕組みを世界に先駆けて明らかにすることに成功した。
夜間に上昇したNEが、上昇した食作用能をβ1-AR-EPAC-SHIP1経路を介して抑制し眼房水排出を抑制
この経路の重要性をマウス点眼実験で眼圧変動を検証したところ、β1-AR刺激で昼間の眼圧が上昇し、それはβ1-AR-EPAC-SHIP1経路および食作用抑制を介していることを明らかにした。さらに、夜間の眼圧上昇にもこの経路が寄与することが判明。眼房水排出抑制による眼圧概日リズムの制御機構を初めて明らかにした。これらの研究成果から、夜間に上昇した上頚神経節由来のNEが、昼間PIP3によって上昇していた食作用能をβ1-AR-EPAC-SHIP1経路を介して抑制し、眼房水排出を抑制することで夜間眼圧上昇を生み出す仕組みが示唆された。
今回の知見が、緑内障の時間依存治療や新規治療薬の開発に役立つ可能性
今回の研究成果により、NEによる眼房水排出機構への時刻依存的制御が明らかにされた一方で、GCの関与や細胞骨格への時刻依存的影響および眼房水産生機構の概日制御機構は不明のままなど、眼圧リズムを生み出すメカニズムを完全には解明できていない。研究グループは今後、眼圧リズムの制御機構の全容解明を目指すとしている。
同研究はNEが食作用を抑制する仕組みを世界で初めて明らかにした研究であり、時間生物学や眼科学以外だけでなく免疫学や感染症学に大きなインパクトを与えることが期待される。「本研究で確立したアッセイ系や明らかになったシグナル伝達経路は、緑内障の時間依存治療や新規治療薬の開発に役立つことが期待される」と、研究グループは述べている。
▼関連リンク
・愛知医科大学 お知らせ








