小脳の顆粒細胞前駆細胞、増殖性と未分化性の協調制御機構は?
国立精神・神経医療研究センター(NCNP)は6月4日、未分化状態で細胞分裂を繰り返す神経前駆細胞・幹細胞が、いかにして細胞分裂を停止し神経細胞へと最終分化するのかについての、新しいメカニズムを発見したと発表した。この研究は、NCNP神経研究所、病態生化学研究部の星野幹雄部長・宮下聡研究員の研究グループによるもの。研究成果は、「The EMBO Journal」に掲載されている。
画像はリリースより
脳は、その発達段階において、神経前駆細胞(あるいは神経幹細胞)が増殖を繰り返し、神経細胞を生み出すことによって、作り出される。神経前駆細胞が「未分化(未成熟)」かつ「増殖性」の細胞であるのに対して、神経細胞は「分化し」かつ「増殖性を失った」細胞だ。しかしながら、脳の発達過程においてこれらの「未分化性」と「増殖性」を同時並行的に一致させて制御するメカニズムはよくわかっていなかった。
研究グループは、この未解決の問題にアプローチするために、小脳をモデル系として用いて研究した。小脳の顆粒細胞は、中枢神経系に存在する全神経細胞のうち、50%以上を占めるほど多数存在する興奮性の神経細胞。この神経細胞は、増殖性かつ未分化状態の顆粒細胞前駆細胞という神経前駆細胞から生み出される。この前駆細胞は、増殖性が極端に上昇するとがん化する一方で、増殖が不十分だと小脳機能不全の原因となる。つまり小脳が正常に機能するためには、顆粒細胞前駆細胞の「未分化性」と「増殖性」が正しく制御され、顆粒細胞が適切な数だけ生み出されることが必要だ。
研究グループは、これまで小脳の顆粒細胞前駆細胞の増殖と分化についての研究を重ね、細胞分裂面の角度と神経細胞発生との関連や、がん関連分子MEIS1やタンパク質分解系分子群が小脳顆粒細胞発生に果たす役割などについて明らかにしてきた。こうした過去の成果を土台とすることによって、小脳をモデル系として、神経前駆細胞から神経細胞へと分化する際の、増殖性と未分化性の協調制御機構を研究することとした。
段階的に「未分化性」と「増殖性」を変化させていた
マウスの小脳において顆粒細胞は、生後2~3週間の間に顆粒細胞前駆細胞から生み出される。研究グループは、シングルセルRNAseqデータを活用したビッグデータ解析を行った。そして、そこから得られた結果を、マウスにおいて検証することによって、顆粒細胞前駆細胞が、最初は「活発に増殖を行う、より未分化な前駆細胞(AT+GCPs)」として存在するが、徐々に「分化した神経細胞へと向かう途中段階の前駆細胞(ND+GCPs)」へと状態を変化させ、その後に神経細胞へと分化するということがわかった。このように、段階的に「未分化性」と「増殖性」を変化させることによって、過不足なく、適切な数の顆粒細胞が生み出されると考えられるという。
CCND1の量で「未分化性」と「増殖性」が協調的に制御されていた
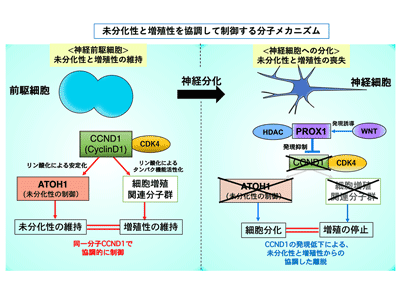
次に研究グループは、顆粒細胞前駆細胞について、これまでに未分化性の維持に関わることが知られていた転写因子ATOH1と、細胞増殖を促進することが知られていた細胞周期関連分子CyclinD1(CCND1)に着目。発達途上のマウス小脳の顆粒細胞前駆細胞に遺伝子導入し、これらの分子の働きを強めたり弱めたりする実験を行った。結果、ATOH1やCCND1が「活発に増殖を行うより未分化な前駆細胞(AT+GCPs)」としての性質の維持に必要とされることが明らかになった。
さらに、培養細胞を用いた実験により、CCND1がCDK4というリン酸化酵素と共役することによってATOH1タンパク質をリン酸化することで(309番目のセリン残基)、ATOH1タンパク質を安定化させることも見出した。もともとCCND1は「増殖性」の促進に働くことが知られていたが、この研究結果は、このタンパク質がATOH1タンパク質の安定化を介して「未分化性」の維持にも働くということを示しているという。つまり、CCND1という1つのタンパク質の量をコントロールするだけで、神経前駆細胞の中で「未分化性」と「増殖性」を協調して制御できる、ということが明らかになった。
小脳の発達過程では、初期には多くの顆粒細胞前駆細胞が「未分化性」と「増殖性」を保ちつつも少数の顆粒細胞を生み出すが、小脳の発生が進むと、顆粒細胞前駆細胞は徐々にその増殖性と未分化性を失い、神経細胞へと分化する確率が増えることが知られている。研究グループは、発生が進むにつれてCCND1のタンパク質量が徐々に減少することを見出した。また遺伝子導入実験から、発達過程におけるCCND1の量の減少が顆粒細胞前駆細胞から神経細胞への分化の促進の原因となることが示唆された。
WNTシグナルがより上位でCCND1の量をコントロール
では、このCCND1タンパク質の量はどのように制御されているのだろうか。研究グループは、さまざまな発生現象に関わるWNTシグナルが小脳発生の初期では小脳全体で低いものの、発生の後期になるに従って小脳全体で上昇していくことを発見。また、小脳顆粒細胞前駆細胞では、WNTシグナルの上昇によって転写因子PROX1の発現も上昇すること、さらに、上昇したPROX1がCCND1の発現抑制に働くことを見出した。すなわち、小脳顆粒細胞前駆細胞においては、CCND1という単一分子が「未分化性」と「増殖性」をコントロールすることによって、この両者を協調して同じ方向へ向かわせることに寄与していることになる。
一部の例外を除いて、一般的に神経前駆細胞から神経細胞へと分化する時にはこの2つの性質が協調して動くことが知られているため、同様なメカニズムが他の脳領域の発達にも関係している可能性が考えられた。また、細胞外からのシグナルであるWNTシグナルがより上位でCCND1の量のコントロールをしていることも明らかとなった。以上より、今回見出された分子ネットワークが、1つひとつの細胞の中での「未分化性」と「増殖性」を制御しているだけではなく、細胞全体のシステムとして細胞増殖に比重をおくか、それとも神経分化にするかというバランスの決定にも寄与していると考えられた。
今回の研究では、顆粒細胞の新しい発生メカニズムと、その分子基盤に関して新しい知見が多く見出された。これらの成果は、顆粒細胞の発生機構だけではなく、進化的な小脳皮質の拡大機構や顆粒細胞のがん化のメカニズムに関しても多くの示唆に富んでいる。また、今回注目された分子や発生メカニズムは小脳にとどまらない。「大脳皮質をはじめとする各脳領域で、これらの分子や発生メカニズムは共通しているため、小脳の研究が、脳全体の共通原理の創出につながっていくことが、今後大いに期待される」と、研究グループは述べている。
▼関連リンク
・国立精神・神経医療研究センター トピックス








