適切な動物モデルを用いた「Off tumor毒性」評価系がない
日本医療研究開発機構(AMED)は6月4日、遺伝子改変キメラ抗原受容体T細胞(CAR-T細胞)療法の安全性を評価するための霊長類モデルを開発したことを発表した。この研究は、同大学術研究院医学系の中沢洋三教授、京都府立医科大学大学院医学研究科の柳生茂希講師(学内)、株式会社イナリサーチの下井昭仁上席執行役員らの研究グループによるもの。研究成果は、「Clinical & Translational Immunology」に掲載されている。
画像はリリースより
一部の白血病や悪性リンパ腫など、血液腫瘍に対するCAR-T細胞は製品化され、日本でも治療に使われている。CAR-T細胞療法の副作用として、CAR-T細胞ががん細胞ではなく誤って正常組織を認識してしまうことによって生じる毒性「Off tumor毒性」が報告されている。CAR-T細胞によるOff tumor毒性は、CAR-T細胞が投与されたのち数時間~数日以内に発症し、万一心臓や肺、脳などの重要臓器にOff tumor毒性が生じた場合には致死的となることから、開発の時点でOff tumor毒性が生じる可能性については十分に評価を行う必要がある。
通常の医薬品開発では、げっ歯類を用いた薬効評価や安全性試験が行われる。CAR-T細胞の薬効評価として、ヒト由来腫瘍をもつ担がん免疫不全マウスモデルを用いた薬効評価が広く行われている。一方、CAR-T細胞が標的とするタンパク質の構造はヒトとげっ歯類では大きく異なることから、CAR-T細胞のOff tumor毒性評価にはげっ歯類を用いた安全性試験を行うことができず、新規CAR-T細胞を開発する際の障壁となっている。ヒト細胞加工製品の非臨床安全性試験においては、免疫不全動物(マウスまたはラット)により安全性試験が実施困難な場合、代替として動物由来の同等製品を利用する、あるいは免疫抑制剤投与下での動物を利用する方法が可能と考えられるが、適切な動物種や試験法は定まっていない。
カニクイザルをモデルにした先行研究で、ヒト由来CAR-T細胞に対し拒絶
この問題を解決するため、研究グループは、ヒトとの相同性が極めて高く、ほとんどのタンパク質の構造が高度にヒトと共通しているカニクイザルからCAR-T細胞を作製し、投与することで、CAR-T細胞のOff tumor毒性を評価する方法(自家移植モデル)を報告していた。この報告では、急性骨髄性白血病や若年骨髄単球性白血病細胞に高発現するGM-CSF受容体を認識、殺傷するCAR-T細胞(GMR-CAR-T細胞)を用いて、自家移植モデルによる安全性評価を行った。
試験14日前にカニクイザルT細胞を用いてGMR-CAR-T細胞を作製し、同一のカニクイザル個体に自家移植し、14日間の観察を実施。移植後のカニクイザル末梢血中ではGMR-CAR-T細胞の細胞数が一過性に上昇したが、その後細胞数は徐々に低下した。投与後のカニクイザルの一般状態(全身状態)、食事摂取量には変化は見られず、発熱、体重減少、呼吸、循環不全など重篤な症状も認められなかった。また、血液・生化学検査、凝固機能検査でも、観察期間中にCAR-T細胞の影響と思われる異常値は認められなかった。さらに、GMR-CAR-T細胞投与後14日目に実施した病理学的検査でも、臓器障害を示唆する異常所見は認められてなかった。
しかし、この自家移植モデルは、カニクイザルのT細胞を用いて、治験製品の代替製品となるCAR-T細胞を作製し、安全性評価を行う試験だ。そのため、実際の治験製品を用いた安全性評価にはならない。一方、実際の治験製品(ヒト由来CAR-T細胞)をカニクイザルに投与すると、カニクイザルリンパ球を介した免疫反応によって速やかに拒絶されてしまう。このため、カニクイザルにおいて、拒絶されずに実際の治験製品(ヒト由来CAR-T細胞)を用いた安全性評価を行うことが可能な方法の開発が求められている。
免疫抑制剤を先行投与し、CAR-T細胞が拒絶されないカニクイザルモデルを開発
現在までに報告されているCAR-T細胞の重篤なOff tumor毒性はそのほとんどが投与後数時間~数日以内に発症する。そこで研究グループは、カニクイザルに免疫抑制剤を先行投与して、数日間カニクイザルのリンパ球機能を抑制するモデルを作ることで、異種であるヒトCAR-T細胞が拒絶されないモデル(異種移植モデル)を作製した。
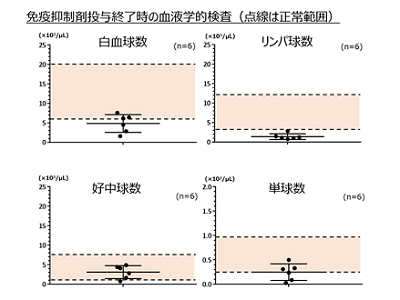
実際、ヒトCAR-T細胞臨床試験でも前処置として用いられている免疫抑制剤(フルダラビン、シクロフォスファミド)をカニクイザルに投与することで、カニクイザルリンパ球数を正常下限以下までに低下させることができ、リンパ球数抑制はCAR-T細胞投与後7日目まで持続したが、好中球数には影響を与えなかった。また、適切な支持療法を行うことで、免疫抑制剤の投与による有害事象(感染症、嘔気、嘔吐、出血性膀胱炎など)はみられなかった。
正常臓器に対するOff tumor毒性が観察されないことを確認
このモデルを用いて、悪性骨軟部腫瘍や乳がんなど、多くのヒト固形がんに高発現し、その悪性度に関与しているEPHB4受容体を標的とするCAR-T細胞(EPHB4-CAR-T細胞)の安全性評価を行った。
まず、ヒトEPHB4-CAR-T細胞は、カニクイザルEPHB4受容体を発現する細胞を認識し、殺傷することを明らかにした。次に、免疫抑制状態にあるカニクイザルに対して、ヒトT細胞より製造したEPHB4-CAR-T細胞を投与。投与後24時間で血中にEPHB4-CAR-T細胞の細胞数が一過性に上昇したが、その後は徐々に低下した。カニクイザルの一般状態(全身状態)、食事摂取量には変化は見られず、発熱、体重減少、呼吸、循環不全など重篤な症状は認められなかった。また、血液・生化学検査、凝固機能検査でも、観察期間中にCAR-T細胞の影響と思われる異常値は認められなかった。
さらに、EPHB4-CAR-T細胞投与後7日目に実施した病理学的検査でも、臓器障害を示唆する異常所見は認められなかった。EPHB4受容体は、発生段階のヒト正常組織に発現するほか、成熟した血管内皮など一部の正常組織にも弱く発現していることが知られているが、同試験の観察期間中には明らかなEPHB4-CAR-T細胞に関連する異常所見は認められなかった。
開発した動物モデルにも課題、特性を十分理解した上で適切な評価系の選択を
これまでCAR-T細胞の開発においては、適切な動物モデルを用いたOff tumor毒性の評価系がないことから、十分な安全性評価ができていなかった。今回研究グループが開発したカニクイザルを用いた自家移植モデル、異種移植モデルは、ヒトとカニクイザルの高い相同性を利用して、予期せぬ重篤なOff tumor毒性の評価を可能にする。一方、これらのカニクイザルモデルにもそれぞれ有用性と課題がある。CAR-T細胞の安全性評価においては、これらの動物モデルの特性を十分理解した上で適切な評価系を選択することで、有効性に加えて、安全性の高いCAR-T細胞の開発につながることが期待される。
同研究の実施施設である「信州大学遺伝子・細胞治療研究開発センター(CARS)イナリサーチラボ」は、再生医療等製品の開発を行う研究グループに広く開放されている。「今後CARSイナリサーチラボの活用により、国産再生医療等製品の国内開発が推進されることが期待される」と、研究グループは述べている。
▼関連リンク
・日本医療研究開発機構(AMED) プレスリリース








