核内受容体が統合失調症の病態に関わる可能性は?
理化学研究所(理研)は12月2日、核内受容体「PPARα」が、統合失調症の新しい治療標的になり得る可能性を発見したと発表した。これは、理研脳神経科学研究センターキャリア形成推進プログラムの前川素子上級研究員(同分子精神遺伝研究チーム研究員)、分子精神遺伝研究チームの和田唯奈大学院生リサーチ・アソシエイト、大西哲生副チームリーダー、吉川武男チームリーダーらの研究グループによるもの。研究成果は、「EBioMedicine」オンライン版に掲載されている。
画像はリリースより
統合失調症は、将来への成長が期待される思春期前後に好発することから、大きな社会問題となっている。また、統合失調症は罹患者数が多いことから(生涯罹患率約1%)、発症による労働力低下や医療コスト増大が改善すべき重要な課題だ。しかし現状では発症メカニズムの理解が不十分であり、新たな治療薬の開発が難しい状況だ。
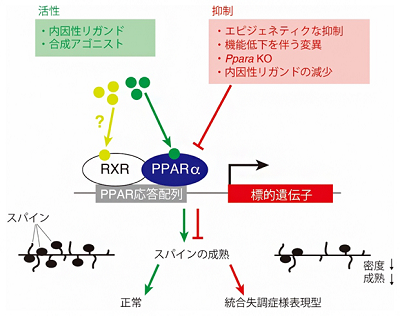
統合失調症の病因について、研究グループらはこれまでに、遺伝要因と環境要因の両方に関わる分子として、多価不飽和脂肪酸(不飽和結合を2つ以上持つ脂肪酸)と脂肪酸結合タンパク質に着目してきた。多価不飽和脂肪酸は、「核内受容体」の内因性リガンドとして遺伝子発現を調節することで、統合失調症の病態形成に関わる可能性が考えられたが、核内受容体と統合失調症病態形成の関連についてはよくわかっていない。
そこで今回、研究グループはヒト遺伝学的解析、遺伝子改変動物や薬理学的統合失調症モデル動物を用いた解析により、核内受容体が統合失調症の病態メカニズムに関わる可能性について調べた。
統合失調症患者からPPARA遺伝子で4種類の変異を同定
多価不飽和脂肪酸を内因性リガンドとする核内受容体として、PPARα、PPARδ、PPARγ、RXRα、RXRβ、RXRγなどが知られている。研究グループは、これらのタンパク質をコードする遺伝子について、統合失調症患者1,200人のDNAを用いて、遺伝子がコードされているエクソン領域の塩基配列を調べるエクソンリシークエンス解析を行い、機能不全をもたらす可能性のある変異を探索した。
その結果、PPARαをコードする「PPARA遺伝子」において、1種類のスプライスアクセプターサイト変異、3種類のミスセンス変異を同定した。これらの変異は、東北メディカルメガバンクで公開されている、一般人口のゲノム配列では見つからず、統合失調症にしか見られなかったことから、統合失調症の発症に寄与している可能性がある。また、これらの変異について、機能解析を実施したところ、発見した4変異は全てPPARA遺伝子の機能不全を誘導する可能性が高いことが明らかになった。
PPARA遺伝子破壊マウスでスパイン密度の低下
次に、PPARαの機能低下と統合失調症発症の脆弱性の因果関係を個体レベルで明らかにするため、CRISPR/Cas9n法を用いてPPARA遺伝子破壊マウス(Ppara KOマウス)を作製して表現型の解析を行った。その結果、Ppara KOマウスでは、統合失調症の中間表現型(疾患と関連する表現型で、検査によって定量可能なもの)の1つとして知られるプレパルス抑制の低下、不安の行動評価に用いられるガラス玉覆い隠し試験で、ガラス玉埋め隠し行動の亢進を示すことを見出した。
また、Ppara KOマウスの脳の組織学的解析では、統合失調症の死後脳解析でも報告されている大脳皮質前頭前野のスパイン(神経細胞の樹状突起にある棘状の構造)密度の低下、スパイン形態の異常(未熟スパインの増加と成熟スパインの減少)が起こることを見出した。以上の結果から、PPARA遺伝子の機能不全が統合失調症の発症リスクにつながる可能性を示した。
フェノフィブラートが統合失調症様表現型の改善する可能性
PPARαの下流因子を探索する目的で、Ppara KOマウスと野生型マウスの大脳皮質を用いて、RNA-seq法により網羅的遺伝子発現解析を行った。その結果、Ppara KOマウスでは、シナプス形成に関連する遺伝子の発現変動が起きていることがわかった。これらの遺伝子については、プロモーター領域にPPARαの結合コンセンサス配列が複数存在していることから、PPARαが直接的にこれらの発現を制御している可能性が考えられる。
最後に、PPARαの機能低下が統合失調症の病態形成に関わるとすれば、PPARα活性化剤(アゴニスト)が治療に使用できるのではないかと考え、統合失調症モデル動物を用いて検討した。まず、NMDA受容体阻害薬であるフェンサイクリジン(PCP)を投与した薬理学的統合失調症モデルマウスを作製し、大脳皮質前頭前野の神経細胞にスパイン形態の異常(未熟型スパインの増加と成熟型スパインの減少)が起こることを見出した。
この動物に対してPPARαアゴニストの1つであるフェノフィブラートを投与すると、これらのスパイン形態の異常が改善することがわかった。また、野生型マウスに対して、フェノフィブラートを事前投与しておくと、NMDA受容体阻害薬でPCPと同様に、統合失調症様症状を引き起こすMK-801による自発運動量の亢進が緩和されることが明らかになった。以上の結果から、PPARαの機能不全がスパイン形成不全を介して統合失調症の病態形成に関わり、PPARαが統合失調症の新しい治療標的になり得る可能性が示された。
副作用の少ないPPARαのアゴニストの開発に期待
今回の研究で、統合失調症患者の中に核内受容体PPARαの機能不全を示す一群が存在する可能性を示し、PPARαの活性化が統合失調症の治療に役立つ可能性を明らかにした。統合失調症の治療薬として、これまでは主にドーパミンD2受容体阻害剤が使われてきたが、その治療効果には限界があることが知られていた。今回、PPARαが統合失調症の治療ターゲットになり得ることが発見されたことで、新しい分子メカニズムによる統合失調症の治療薬開発への道がひらける可能性がある。
「今回用いたPPARαのアゴニストのフェノフィブラートは、脂質代謝治療薬として臨床で広く使用されているが、重篤な副作用も報告されていることから、臨床応用に関しては、今後より副作用の少ないPPARαのアゴニストを開発するなどの工夫が必要であると考えられる」と、研究グループは述べている。
▼関連リンク
・理化学研究所 プレスリリース








