体内の可溶性プリオンが、どのように異種間の感染効率を制御しているか?
理化学研究所(理研)は4月14日、生体内に存在する可溶性プリオンタンパク質の短い天然変性領域における特定の揺らいだ構造が、異種間でのプリオン感染効率の制御に関与していることを明らかにしたと発表した。この研究は、理研脳神経科学研究センタータンパク質構造疾患研究チームの田中元雅チームリーダー、志田俊信研修生・大学院生リサーチ・アソシエイト(研究当時)らの国際共同研究グループによるもの。研究成果は、「Nature Chemical Biology」のオンライン版に掲載されている。
画像はリリースより
哺乳類が患う神経変性疾患の中で、「プリオン病」はプリオンタンパク質を介した感染性を示すという大きな特徴がある。ウシからヒトへのプリオン病の感染がまれなように、プリオンタンパク質のごく少数のアミノ酸配列の違いによって、異種間でのプリオン感染性は大きく減少する。ウシからヒトへの異種間のプリオン感染は、生体内に存在する可溶性プリオンタンパク質が、異種由来のプリオンタンパク質凝集体と偶発的に凝集反応することで引き起こされると考えられている。このような現象は「種の壁」として知られているが、体内の可溶性プリオンタンパク質が、どのように異種間のプリオン感染効率を制御しているかは不明のままだった。
そこで研究グループは、これまでプリオン感染現象の解明に大きく貢献してきた酵母プリオンタンパク質の実験系を用いて、種の壁を越えるプリオン感染の分子メカニズムの問題に取り組むことにした。その際、これまでの哺乳類および酵母プリオン感染研究では、近縁種由来のタンパク質(アミノ酸配列の類似性が高い)が用いられてきたが、今回の研究では2つの遠縁種由来のタンパク質(アミノ酸配列の類似性が低い)を用いることで、種の壁の分子構造基盤がより明らかにできるのではないかと考えた。また、異種由来のプリオンタンパク質凝集体ではなく、生体内に存在する可溶性プリオンタンパク質を調べることで、感染性の制御機構についての知見が得られるのではないかと考えた。
短い天然変性領域での特定の揺らいだ構造が異種間プリオン感染効率を高度に制御
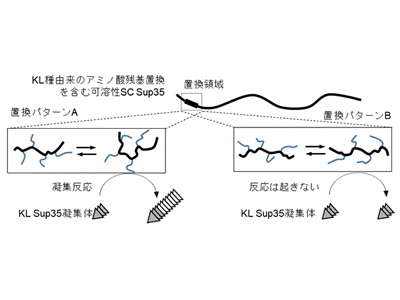
研究グループは、S. cerevisiae(SC)およびK. lactis(KL)という2つの遠縁酵母種由来のSup35プリオンタンパク質を用いて研究を実施。これまでのSup35タンパク質研究においては、SCを用いた研究が長らく行われ、プリオン感染時の表現型などの判別がより確立されている。このような経緯を踏まえて、上記2種の酵母を用いた感染研究を進めるにあたり、SCを「感染される側」に設定した。また、この2種間での感染メカニズムを調べる上で、SCに内在する可溶性Sup35タンパク質が、どのようにKL由来のSup35タンパク質凝集体との反応性を獲得するか調べた。
可溶性Sup35タンパク質の凝集形成に関わる領域は天然変性であり、特定の折り畳まれた立体構造をとらない。このような構造上の特性を持つタンパク質を用いて異種間プリオン感染解析を行うため、高分解能の核磁気共鳴(NMR)法実験を中心に、試験管内での系統的な遺伝子変異解析、酵母を用いた生体内でのプリオン感染実験、分子動力学計算を用いたシミュレーションなどの多様な研究手法を取り入れた。
まず、SCとKL由来の可溶性Sup35タンパク質の動きを、NMR測定法による速い時間スケールの構造揺らぎを観察できる1H-15N異種核NOE測定によって比較したところ、動きが大きく異なっている短い領域が存在することがわかった。この領域は、凝集体形成の中心部位として知られるアミノ末端の約70アミノ酸残基内に存在しており、同じタンパク質であっても、種が異なると局所的に違いが存在することを示している。
次に、このようなSup35タンパク質の局所的な動きの違いが感染性に関係しているのかを調べるために、SC由来のSup35タンパク質の動きが大きく異なっていた領域内において、KL由来の同領域のアミノ酸残基に置換したキメラタンパク質を作製。その結果、わずか5アミノ酸残基の置換だけでも、局所的に動きと構造がKL由来の可溶性Sup35タンパク質のように変化し、試験管内および酵母内での異種間プリオン感染が生じることがわかった。さらに、このようなアミノ酸置換を含んだ短い天然変性領域内においては、メチレン基(=CH2)の有無というアミノ酸側鎖間のわずかな構造の違い(グルタミンとアスパラギンの違い)でさえ、短い天然変性領域の構造を大きく変化させ、KL由来のプリオンタンパク質凝集体との凝集反応を制御できることが明らかになった。以上の結果から、生体内に存在する可溶性Sup35タンパク質に含まれる短い天然変性領域での特定の揺らいだ構造が、遠縁種由来の異種間プリオン感染効率を高度に制御していると判明した。
神経変性疾患の患者脳で生じる異なるタンパク質間での共凝集の理解にも役立つと期待
今回の研究成果は、酵母におけるプリオン感染現象の解明にとどまらず、哺乳類におけるプリオン感染現象である種の壁の解明に貢献すると期待できるもの。酵母プリオンタンパク質Sup35と異なり、哺乳類におけるプリオンタンパク質は折り畳まれた立体構造を取っているが、10残基程度の短いループ構造の天然変性領域を含んでいる。これまでの研究では、このループ構造が哺乳類種間においてわずかに異なっていることが示され、異種間プリオン感染に関与していることが示唆されてきた。しかし、このような微細な構造の違いがどのように異種間プリオン感染性を制御しているかは、十分に理解されていなかった。今回の研究により1つのメチレン基の違いのみで天然変性領域の立体構造が変化し、異種間プリオン感染性を変化させることが明らかになったため、上記に述べたループ構造領域の小さな違いが哺乳類におけるプリオンの感染性を高度に制御している可能性が示された。
より広い意味では、神経変性疾患において頻繁に観察されている、異なるタンパク質間での共凝集反応の理解に役立つことが期待できるという。これらの疾患に関連するタンパク質の多くは、凝集してない状態では天然変性領域を含む一方で、凝集する際は異なるタンパク質と共凝集することがしばしば観察されてきた。今回の研究成果は、そのような可溶性の状態のタンパク質が、異なるタンパク質凝集体と共凝集反応を起こし、神経変性疾患を引き起こす現象の理解にも役立つと期待できる。また、このような異なるタンパク質間での共凝集反応は、生体内で有害な影響を与える可能性があるため、それらのタンパク質内の天然変性領域の構造は、疾患予防の効果的な治療標的にもなり得ると研究グループはみている。
▼関連リンク
・理化学研究所 プレスリリース








