PTSDや統合失調症に関連のクラスB GPCR「PAC1受容体」
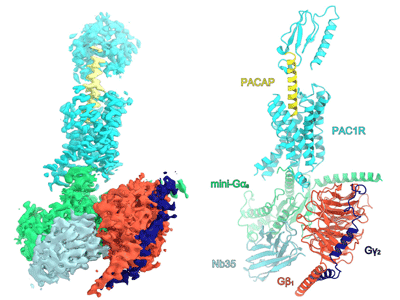
東京大学は3月10日、クライオ電子顕微鏡を用いた単粒子解析によって、PACAP、PAC1受容体およびGタンパク質からなるシグナル伝達複合体の立体構造を解明したと発表した。この研究は、同大大学院理学系研究科の小林和弘大学院生、志甫谷渉研究員、西澤知宏助教、濡木理教授、東北大学大学院薬学研究科の井上飛鳥准教授らの研究グループによるもの。研究成果は、「Nature Structural and Molecular Biology」に掲載されている。
画像はリリースより
ヒトは内分泌系を用いて体内環境の恒常性を維持している。GPCRは内分泌を制御するタンパク質として最大のファミリーを形成しており、ヒトで約800種類存在している。GPCRは各々が異なったリガンドを受容することで活性化され、細胞内情報伝達分子であるGタンパク質三量体を活性化する。800種類のGPCRは複数種類のGタンパク質をさまざまなレベルで活性化しており、生体内における多様な生命現象を制御している。このような背景から、既存薬の30〜40%がGPCRを標的としている。GPCRはその特徴に基づいていくつかのクラスに分類され、その中でもクラスB GPCRと呼ばれるグループは慢性疾患の創薬標的を多く含み、慢性病態の理解に向けて研究が進められてきた。クラスB GPCRはペプチドホルモンを受容するグループとして知られており、膜貫通ドメインに加えて細胞外ドメインが存在することが知られている。クラスB GPCRがペプチドホルモンを認識する際には、この細胞外ドメインが重要であると考えられている。
クラスB GPCRの1種「PAC1受容体」は、下垂体アデニル酸シクラーゼ活性化ポリペプチド(PACAP)を受容する。PACAP受容体としては、他にも類縁受容体VPAC1やVPAC2が存在している。PAC1受容体は中枢神経系および末梢組織に広く存在し、さまざまな機能を有している。中でも、PACAPによるPAC1受容体経路の活性化は、心的外傷後ストレス障害(PTSD)の根底にある異常なストレス応答を引き起こす。また、PAC1遺伝子の多型は統合失調症と関連している。このことから、PAC1受容体は多くの精神障害に対する薬物標的として研究されてきた。さらにPAC1受容体は涙腺に発現しており、PACAPにより活性化されて涙液分泌を促進作用する作用があるため、ドライアイ症候群の創薬標的にもなっている。しかし、PAC1受容体を標的とした低分子薬剤は存在せず、そのリガンド認識メカニズムと受容体の構造は不明であり、さらなる受容体研究や医薬品開発が阻まれていた。
細胞外ドメインはリガンド受容に重要だが、活性化に必須ではないと判明
今回、研究グループは、2018年度に東京大学に設置されたクライオ電子顕微鏡を用いてPACAPリガンド、ヒト由来PAC1受容体、Gsタンパク質三量体からなるシグナル伝達複合体の立体構造を原子分解能で決定した。PAC1受容体の膜貫通領域の構造は第6膜貫通ヘリックス(TM6)で大きく折れ曲り、典型的なクラスB GPCRの活性化型構造を取っていた。その受容体の活性化においては、折れ曲がっている部分のプロリン残基が重要であることが示唆されていたが、立体構造に基づく変異体機能解析により、プロリンではなくその近傍のグリシン残基が重要であることが判明した。複合体構造中では、PACAPのN末端側の14残基がPAC1受容体の膜貫通領域と広範な相互作用を形成していた。特にPAC1RのTM1及びTM7と密な相互作用を形成しており、これらの相互作用がPACAPの認識に重要であることがわかった。
一方で、PACAPは、細胞外ドメインとは強固な結合が見られなかった。クラスB GPCRで最もよく研究されているグルカゴン用1型(GLP-1)受容体では、細胞外ドメインとリガンドの強固な相互作用が見られる。そこで研究グループは、これらの受容体の細胞外ドメインの機能解明を目指し、PAC1及びGLP-1受容体の細胞外ドメインと相互作用できないリガンドを作製して、細胞外ドメインの持つ機能の違いを解析した。
その結果、GLP-1受容体は細胞外ドメインとリガンドの相互作用を失うと受容体の活性化自体が不可能になる一方で、PAC1受容体では細胞外ドメインとリガンドの相互作用が失われても、全長のリガンドと同レベルまで受容体を活性化できることがわかった。これにより、PACAPはPAC1受容体の膜貫通領域との相互作用だけのみで受容体を完全に活性化可能であることが明らかになった。しかし、細胞外ドメインとの相互作用を失ったPACAPリガンドは受容体との親和性が大きく低下することから、PAC1受容体の細胞外ドメインはリガンドとの高い親和性を生み出すために重要であることが明らかになった。
膜貫通部位と選択的に相互作用する薬剤開発に期待
今回の研究により、世界で初めてPAC1受容体の立体構造が決定された。PAC1受容体は類似受容体VPAC1やVPAC2が存在するため、PAC1受容体選択的な薬剤の創出が困難だった。今回、PAC1受容体は細胞外ドメインによりリガンドの親和性を高める一方で、その受容体膜貫通部位との相互作用のみにより活性化可能であることが明らかになった。研究グループは、「今後、本構造情報を活用した、PAC1受容体の膜貫通部位と選択的に相互作用できる低分子薬剤の開発が期待される」と、述べている。
▼関連リンク
・東京大学大学院理学系研究科・理学部 プレスリリース








