胎盤の機能不全で、子宮内発育遅延や流産などが発生
理化学研究所は10月8日、マウスの胎盤・胎児の正常な発生に必要なアミノ酸トランスポーター(アミノ酸の細胞膜透過を担う膜タンパク質)を発見したと発表した。この研究は、理研バイオリソース研究センター遺伝工学基盤技術室の的場章悟専任研究員、小倉淳郎室長(開拓研究本部小倉発生遺伝工学研究室 主任研究員)らの共同研究グループによるもの。研究成果は、「Proceedings of the National Academy of Sciences 」(PNAS)のオンライン版に掲載されている。
画像はリリースより
哺乳類の胎盤は、胚発生を支えるさまざまな機能を持っている。胎盤の機能の中でも特に重要なのは、母体-胎児間の血流を介して栄養やガス、老廃物などのやりとりをし、胎児が正常に発生できる環境を用意することだ。胎盤の機能不全があると、胚の発生に悪影響を及ぼし、結果として子宮内発育遅延(Intrauterine growth restriction; IUGR)や流産などを引き起こす。さらに最近の研究では、胎児期の栄養環境が悪化すると、胎児の全身での代謝プログラムが変化してしまい、生後も長期にわたって健康状態に悪影響を及ぼす可能性が示唆されている。そのような重要性にもかかわらず、胎盤の機能、特に母体から胎児への栄養供給に関わる分子メカニズムはほとんど解析されていなかった。
これまで主にヒトの胎盤由来の細胞を用いた研究において、システムAアミノ酸トランスポーターの活性と胎盤の機能および胎児の正常性との間に相関が見られたことから、システムAアミノ酸トランスポーターが胎盤の形成や胎児の発生機能に重要な役割を果たすことが示唆されてきた。しかし、個体レベルで遺伝子の機能を解析した報告はなかった。そこで今回、共同研究グループは、マウスを用いてシステムAアミノ酸トランスポーターをコードするSNATファミリー遺伝子(Slc38a1、Slc38a2、Slc38a4)の機能の遺伝的解析を試みた。
Slc38a4/SNAT4異常で胎盤低形成・胎児発育遅延
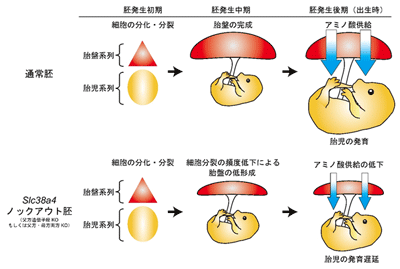
共同研究グループはまず、SNATファミリー遺伝子のさまざまなマウス組織における発現を解析した。その結果、3つの遺伝子は全て、胎盤で高いレベルで発現していることがわかった。そこで、Triple-target CRISPR法によって3種類のSNATファミリー遺伝子をそれぞれノックアウトしたマウスを作製して、胎盤への影響をスクリーニングした。すると、Slc38a4をノックアウトした場合のみ、出生時の胎盤の重量がコントロール群と比べて30%ほど減少した。さらに、Slc38a4ノックアウトマウスでは出生時の産仔重量も25%ほど減少し、出生直後に7割以上の産仔が死亡した。これらの結果から、SNATファミリー遺伝子の中でもSlc38a4が胎盤の形成および胎児の発生に重要な機能を持つことが判明した。
次に、詳細な発生プロセスを解析するために、作製したノックアウトマウスの中からSlc38a4遺伝子領域をほぼ全て欠失しているものを選び、ラインを樹立して解析を進めた。まず、マウスのSlc38a4は父方遺伝子座から発現するインプリント遺伝子であるため、父方遺伝子座を欠損した(母方遺伝子座は正常)ヘテロ胚を作製したところ、ホモでのノックアウト胚と同様の胎盤低形成・胎児発育遅延の表現型を示した。また、胎盤形成途中の変化を経時的に観察すると、Slc38a4ノックアウト胚で見られる胎盤の低形成は、胎盤形成中期頃から認められるのに対し、胎児の発生遅延は比較的後期から起きることから、胎盤の機能不全が原因で胎児が発生異常を示す可能性が考えられた。そこで、免疫染色法によって、正常マウス胚の胎盤形成過程でのSNAT4タンパク質の局在を見ると、胎盤形成初期の絨毛膜領域(未分化な胎盤幹細胞が多く存在する領域)で強く発現しており、ノックアウト胚ではこの領域の細胞分裂頻度が低下していた。したがって、この細胞分裂頻度の低下がノックアウト胚で認められる胎盤低形成の原因だと考えられた。
Slc38a4/SNAT4は、母体から胎児へのアミノ酸の供給に重要
一方、正常マウスでSNAT4タンパク質の局在を見ると、胎盤形成中期以降は母体-胎児間の栄養交換を行うラビリンス層の栄養膜細胞でも発現していた。そこでSlc38a4ノックアウト胚では母体から胎児へのアミノ酸供給に異常があるのではないかと考え、胎児血漿のメタボローム解析を実施。その結果、Slc38a4ノックアウト胚では、SNAT4のトランスポートターゲットであるグルタミンなどを含む多くのアミノ酸の血中濃度が著しく低下していた。また、SNAT4は同じSNATファミリーに属するSNAT1やSNAT2と異なり、ヒスチジンなどのカチオン性アミノ酸もトランスポートするという特徴があるが、実際にSlc38a4ノックアウトマウスの胎児血漿では、ヒスチジン濃度が大幅に低下していた。以上の結果から、SNAT4は母体から胎児へのアミノ酸の供給において重要な機能を持つことが強く示唆された。
今回の研究では、SNAT4がマウスの胎盤形成および胚発生において重要な機能を持つことが示された。Slc38a4/SNAT4はヒトを含めた他の哺乳動物種の胎盤でも発現しているため、他の動物でも同様の機能を持つのかを検証する必要がある。一方で、「Slc38a4ノックアウトマウスは子宮内発育遅延(IUGR)の良いモデルとなるため、本マウスを利用して、IUGRの病態の理解や治療法の開発にもつながる可能性がある」と、研究グループは述べている。
▼関連リンク
・理化学研究所 プレスリリース








