Aβの毒性凝集体ASPDは脳内でどう作られるのか
京都大学は3月1日、アルツハイマー病の神経毒性物質の形成と伝搬機構を解明したと発表した。この研究は、同大大学院医学研究科の星美奈子特定准教授(現・神戶医療産業都市推進機構先端医療研究センター神経変性疾患研究部長、京都大学大学院医学研究科非常勤講師)らの研究グループによるもの。研究成果は「iScience」に同日付で掲載された。
画像はリリースより
アルツハイマー病の原因となるアミロイドβ(Aβ)は、APP(アミロイドβ前駆体タンパク質)が、神経細胞内を輸送される過程で切断されて産生される。これまでAβが産生されるメカニズムについては、ほとんど神経細胞以外の細胞を用いて解析されてきた。しかし、神経細胞は情報を外から受け取る樹状突起、情報を処理する細胞体、情報を発信する軸索と、全く異なる機能を担う部位から形成されており、機能的に異なる部位を作るために、普通の細胞よりも極めて複雑な細胞内輸送システムを持っている。こうした神経細胞において、Aβがどこで産生されているか、どこで毒性を持つ凝集体に変わるのかは、明らかになっていなかった。
また、近年、アルツハイマー病の原因として、比較的少数のタンパク質が凝集した「オリゴマー」が毒性発揮の中心的役割を担うと考えられている。研究グループは以前、Aβが30個集まった球状構造体「アミロスフェロイド(ASPD)」が強い神経毒性を持つことを報告した。また、これまでの研究により、ASPDがアルツハイマー病の病態に重要な働きを持つことが示唆されている。しかし、ASPDが脳内でどのようにして形成されているかについては不明だった。
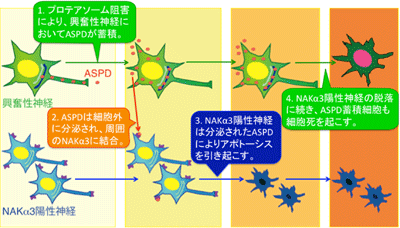
プロテアソームの活性低下でASPDが蓄積
そこで今回研究グループは、ASPDやAβが神経細胞内のどこで形成し、どのようにして伝播するかを調べるために、ASPDを産生する成熟神経細胞をモデルとして構築した。この神経細胞に、家族性アルツハイマー病で報告されている変異を持つAPPを発現させ、異常タンパク質の分解を行う酵素複合体「プロテアソーム」の働きを阻害したところ、一部の神経細胞内にASPDの蓄積が見られた。詳しく調べたところ、ASPDを蓄積したのは、神経細胞の活動を活性化する「興奮性神経細胞」だった。また、ASPDは、通常状態では主に細胞の軸索に多く存在していたが、プロテアソームを阻害すると主に樹状突起に存在するようになった。ASPDの蓄積は、細胞内で生成されたタンパク質の仕分けに重要な働きを持つ「トランスゴルジネットワーク」に多くみられ、細胞内輸送の異常とASPDの蓄積が密接に関係していることが示唆された。
次に、興奮性神経細胞内で形成したASPDが、細胞外に分泌されているかを調べたところ、実際に細胞外に分泌されていると判明。興奮性神経細胞から細胞外に分泌されたASPDは、周囲の神経細胞の「ナトリウム-カリウムポンプのα3サブユニット(NAKα3)」という、細胞の生存や機能に重要なタンパク質に結合し、NAKα3を持つ神経細胞の細胞死を引き起こしていた。さらに、周囲のNAKα3神経細胞の細胞死を引き起こしたASPD蓄積細胞は、その後、NAKα3神経細胞とは異なるメカニズムで細胞死を起こすとわかった。
今回の研究により、神経細胞における毒性Aβオリゴマーの形成と輸送に関して、より明確に説明がつくようになったとともに、プロテアソームの活性とASPDの蓄積に相関があることが⽰唆され、プロテアソームの活性がアルツハイマー病の病態に重要な働きを持つ可能性が⽰された。この結果は将来的に、APP/Aβの分解を調節することによる、Aβ凝集体に対するアルツハイマー病治療薬の開発につながることが期待できると研究グループは述べている。
▼関連リンク
・京都大学 研究成果








