「糖鎖の非リソソーム分解機構」に未解明な部分多く
理化学研究所は2月16日、理研グローバル研究クラスタシステム糖鎖生物学研究グループ糖鎖代謝学研究チームの鈴木匡チームリーダー、原田陽一郎特別研究員らの共同研究グループが、リン酸化された糖鎖の新しい代謝機構を解明したと発表した。この研究は、米国の科学雑誌「Journal of Biological Chemistry」に掲載されるのに先立ち、オンライン版に2月8日付けで掲載された。
画像はリリースより
共同研究グループによると、タンパク質の翻訳後修飾のひとつに、アスパラギン残基(N)に付加される糖鎖(N型糖鎖)があり、タンパク質の安定性や輸送、機能などの制御に重要な役割を果たしている。役目を終えた糖タンパク質(N型糖鎖で修飾されたタンパク質)は細胞内のリソソームに運ばれた後、アミノ酸と糖にまで分解される。しかし、N型糖鎖の分解が正しく行われないと、さまざまな病気が引き起こされることがわかっている。また、近年、糖鎖の分解がリソソーム以外の場所でも起こる「糖鎖の非リソソーム分解機構」の存在が明らかになってきたが、その仕組みはよくわかっていない。
N型糖鎖の前駆体は、ドリコールピロリン酸と呼ばれる脂質に結合した状態で存在している。この「ドリコール結合型糖鎖」は、未知の酵素によって分解されて「リン酸化糖鎖」を生じる。しかし、リン酸化糖鎖の代謝機構には未解明な点が多く残されている。
糖鎖分解の分子機構の全容解明に一歩前進
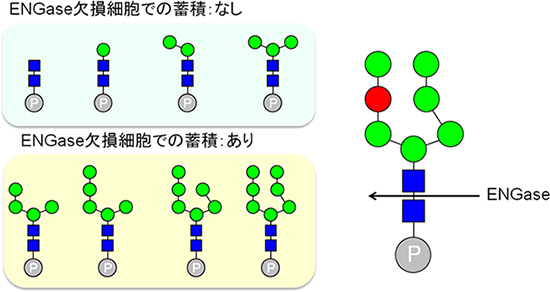
共同研究グループではまず、ドリコール結合型糖鎖の分解産物として存在が知られているリン酸化糖鎖を単離精製し、質量分析をすることで、ドリコール結合型糖鎖のリン酸基の数が1個であることを実験的に証明。また、リン酸化糖鎖が非リソソーム分解機構に関与する細胞質「エンド-β-N-アセチルグルコサミニダーゼ(ENGase)」のノックアウトマウス由来線維芽細胞において蓄積することを発見した。
さらに、比較的大きなリン酸化糖鎖(マンノースが4~7個)は著しく蓄積するのに対し、小さいリン酸化糖鎖(マンノースが0~3個)はほとんど蓄積しないことがわかった。これにより、ENGaseが比較的大きなリン酸化糖鎖の分解酵素として働いていると考えられるとしている。この仮説を検証するため、生化学的にENGaseがリン酸化糖鎖を分解できるかどうかを調査。その結果、ENGaseがリン酸化糖鎖を分解できること、その基質特異性(酵素がある特定の器質を選んで反応する性質)がENGase欠損細胞で蓄積するリン酸化糖鎖の構造と一致することがわかった。
これらの結果は、リソソーム以外(細胞質)でENGaseがリン酸化糖鎖の代謝(分解)に関わることを示しており、糖鎖分解の分子機構の全容解明に一歩前進したと研究グループは述べている。
▼関連リンク
・理化学研究所 プレスリリース








