細胞の形態変化と分化のつながり示す
慶應義塾大学医学部先端医科学研究所(遺伝子制御研究部門)の信末博行特任助教、佐谷秀行教授らの研究チームは、日本大学生物資源科学部応用生物科学科の加野浩一郎教授らとの共同研究で、アクチン細胞骨格の動態変化が脂肪細胞への分化を誘導することを発見、その分子機構について解明した。2月26日、慶應義塾大学医学部および科学技術振興機構(JST)より発表されている。なお、この研究成果は英科学専門誌「Nature Communications」オンライン版に、現地時間の2月26日付で掲載された。
(画像はプレスリリースより)
細胞は、種々の転写因子の発現により、機能的・形態的に分化を始めるものとされてきた。未分化な前駆細胞から成熟した脂肪細胞へと分化するときには、転写因子PPARγがはじめに発現する。一方で、細胞は分化に伴ってアクチン細胞骨格を再構成し、それぞれの機能に特徴的な形態変化を遂げていくことが知られている。だが、これらの現象をつなぐ分子機構は、これまでほぼ未解明のままだった。
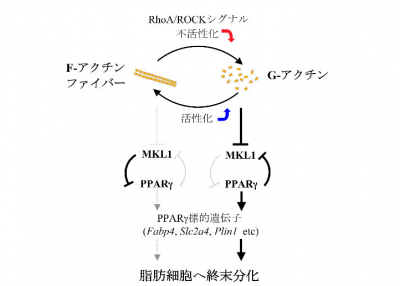
同研究チームは、まずさまざまな細胞に分化する多能性をもった脱分化脂肪細胞株(DFAT)を用い、脂肪分化過程におけるアクチン細胞骨格の変化とPPARγの発現について調べた。すると、DFATでは、分化誘導24時間以内にアクチンファイバーに脱重合が生じ、48時間後にPPARγが発現、脂肪細胞特有の表層アクチンが形成されることが分かった。また、脂肪分化誘導したDFATにおいて、アクチンファイバーの脱重合を阻害したところ、PPARγの発現および脂肪分化が有意に抑制されることも確認できたという。
さらに、アクチンファイバーの形成を誘導するRhoAタンパクの活性型変異体をDFATに強制発現させて分化誘導したところ、アクチンファイバーの形成が促進され、PPARγの発現が抑制されたものの、RhoAタンパクの下流で活性化されるRhoキナーゼの阻害剤、もしくはアクチン重合阻害剤での処理を行うと、アクチンファイバーは脱重合し、PPARγの発現も回復することが見出されたという。これらの事実から、RhoA/Rhoキナーゼシグナルの不活性化がアクチンファイバーの脱重合を促し、PPARγの発現や脂肪分化を直接制御することが分かった。
常識を覆す新概念、癌幹細胞の分化制御を標的とした新たな治療法・治療薬の開発に期待
今回の研究から、アクチンファイバーが脱重合して増加したG−アクチンがMKL1と結合して核への移行を阻害することにより、PPARγが発現し始め、増加したPPARγによってMKL1の発現が抑えられ、脂肪細胞へと終末分化するというメカニズムが見出された。このアクチン細胞骨格の変化が脂肪細胞の分化を誘導するという現象は、一見逆とも思えるメカニズム形態であり、これまでの常識を覆す新たな概念といえる。
同研究チームでは、他の細胞種への分化においても類似のメカニズムが働いている可能性があり、幹細胞から特定の細胞への分化をこれまでよりも容易に誘導できる手段の開発を見込んでいる。また、がん幹細胞を、アクチン動態を制御することで終末分化に導き、治療を行うという方法も可能と考えられ、今後の応用が期待されている。(紫音 裕)
▼外部リンク
慶應義塾大学医学部/科学技術振興機構 プレスリリース
http://www.jst.go.jp/pr/announce/20140226/index.html
Regulation of MKL1 via actin cytoskeleton dynamics drives adipocyte differentiation
http://www.nature.com/ncomms/2014/140226/








